
(1)CH3+ 、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H2O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个-CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①锌在元素周期表中的位置是:_ 。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ,葡萄糖分子[CH2OH(CHOH)4CHO]中碳原子杂化方式有 。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在〔Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
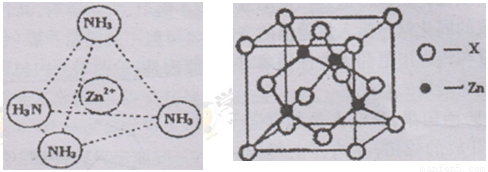
④右上图示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为 。
⑤在④的晶胞(右上图)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___ 堆积;设该晶胞中Zn的半径为r1 cm,其相对原子质量为M1,X的半径为r2cm,其相对原子质量为M2,则该晶体的密度为_ g/cm3 (写出含有字母的表达式)。
(15分)(1)CDE(选对3个得3分,选对2个得2分,选对1个得1分,选错1个得0分)
(2)①第四周期第ⅡB族 (1分) ②1s22s22p63s23p63d10或[Ar]3d10(1分);sp2、sp3(2分)
③极性分子 (1分) 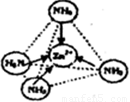 (2分) ④1:1(1分)
(2分) ④1:1(1分)
⑤面心立方最密 (1分) 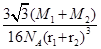 (3分)
(3分)
【解析】
试题分析:(1)A、甲烷分子变成CH3+、CH3-、CH3-时,失去的分别是氢负离子、氢离子和质子,空间构型也不再与原来的分子相同,故A错误;B、CH3+、CH3-、CH3-分别具有6个、7个和8个价电子,不是等电子体,中心碳原子的价层电子对数不同,故空间构型不同,故B错误;C、CH3-与NH3、H3O+均具有10个电子,互为等电子体,几何构型均为三角锥形,故C正确;D、CH3+中的碳原子采取sp2杂化,所有原子均共面,故D正确;E、两个CH3-或一个CH3+和CH3-结合可得到CH3CH3,故E正确,答案选CDE。
(2)①Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期第ⅡB族。
②Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10 ;葡萄糖里有两种碳原子,葡萄糖是五羟基醛,所以碳原子一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳)。
③配位体NH3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,如图所示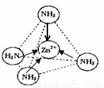 。
。
④根据晶胞得结构简式并依据均摊法可知,晶胞中锌的个数为4,X的个数为8×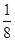 +6×
+6×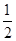 =4,所以化合物的Zn与X的原子个数之比为1:1。
=4,所以化合物的Zn与X的原子个数之比为1:1。
⑤根据晶胞结构特点可知,X的堆积方式属于金属晶体堆积方式中的面心立方最密堆积;设晶胞得边长是a,则根据晶胞结构可知a2+2a2=(4r1+4r2)2,解得a=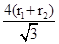 ,则根据
,则根据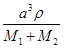 ×NA=4,解得ρ=
×NA=4,解得ρ=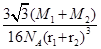 。
。
考点:考查分子空间构型、等电子体、杂化轨道类型、核外电子排布、配位键以及晶体结构的判断和计算


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
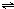 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0.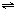 CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
查看答案和解析>>
科目:高中化学 来源: 题型:
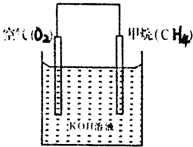 “可燃冰”是一种重要的潜在未来资源.“可燃冰”属于主要成分是CH4的水合物.
“可燃冰”是一种重要的潜在未来资源.“可燃冰”属于主要成分是CH4的水合物.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温 |
| c(CO)c3(H2) |
| c(CH4)c(H2O) |
| c(CO)c3(H2) |
| c(CH4)c(H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com