
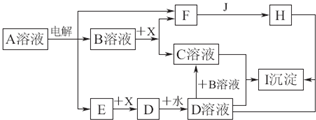
| ||
| ||
| ||
| ||


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:阅读理解
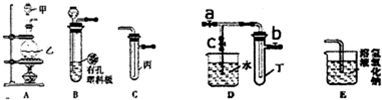
| 实验 序号 |
实验操作 | 现象 | 结论 |
| I | 将氯水滴入品红溶液 | 溶液褪色 | Cl2与水反应的产物有漂白性 |
| II | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | Cl2与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解




查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | A | ||||||
| 2 | B | C | D | E | J | K | L |
| 3 | F | G | H | I | |||
| M |
 它的空间利用率为
它的空间利用率为查看答案和解析>>
科目:高中化学 来源: 题型:
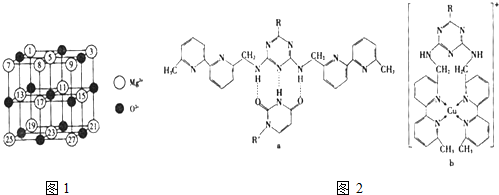
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
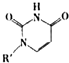 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com