

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
分析 粗铜中含有Fe,粗铜与氯气反应生成CuCl2和FeCl3,加热稀盐酸至固体完全溶解,溶液中含有CuCl2和FeCl3,盐酸能抑制铜离子和铁离子水解,从而得到溶液1;向溶液1中加入试剂X调节溶液pH至4-5,根据铁离子沉淀需要溶液pH值知,铁离子完全沉淀生成Fe(OH)3,铜离子不产生沉淀,过滤得到的固体2是Fe(OH)3,加入的X能和氢离子反应且不能引进新的杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,得到的溶液2为溶液CuCl2,经蒸发浓缩,冷却结晶可得到CuCl2晶体;
(1)①试剂X能和氢离子反应而提高溶液的pH值,且不能引进新的杂质;
②调节溶液pH时,要使铁离子完全沉淀但铜离子不能产生沉淀才能达到分离目的;
(2)铁离子能和KSCN溶液混合得到血红色溶液,利用KSCN检验铁离子;
(3)向溶液Ⅱ中含有氯化铜,氯化铜和H2S反应生成盐酸和CuS;
(4)①碘遇淀粉试液变蓝色,所以要用淀粉检验碘单质;
②达到滴定终点时,仰视滴定管读数将使测定结果偏高;
③依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,根据反应的离子方程式计算分析;
(5)CuCl2•2H2O晶体受热时生成水,氯化铜水解生成氢氧化铜和HCl,所以要想得到晶体CuCl2,应该抑制氯化铜水解.
解答 解:粗铜中含有Fe,粗铜与氯气反应生成CuCl2和FeCl3,加热稀盐酸至固体完全溶解,溶液中含有CuCl2和FeCl3,盐酸能抑制铜离子和铁离子水解,从而得到溶液1;向溶液1中加入试剂X调节溶液pH至4-5,根据铁离子沉淀需要溶液pH值知,铁离子完全沉淀生成Fe(OH)3,铜离子不产生沉淀,过滤得到的固体2是Fe(OH)3,加入的X能和氢离子反应且不能引进新的杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,得到的溶液2为溶液CuCl2,经蒸发浓缩,冷却结晶可得到CuCl2晶体;
(1)①试剂X能和氢离子反应而提高溶液的pH值,且不能引进新的杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,故选bd;
②调节溶液pH时,要使铁离子完全沉淀但铜离子不能产生沉淀才能达到分离目的,所以其pH范围为3.2≤pH<4.7,故答案为:3.2≤pH<4.7;
(2)铁离子能和KSCN溶液混合得到血红色溶液,利用KSCN检验铁离子,其检验方法为取少量溶液I于试管中,滴加KSCN溶液,若溶液变红色,证明溶液里有Fe3+,故答案为:取少量溶液I于试管中,滴加KSCN溶液,若溶液变红色,证明溶液里有Fe3+;
(3)向溶液Ⅱ中含有氯化铜,氯化铜和H2S反应生成盐酸和CuS,盐酸是强酸,导致溶液中氢离子浓度增大,溶液的pH降低,离子方程式为H2S+Cu2+=CuS↓+2H+,故答案为:H2S+Cu2+=CuS↓+2H+;
(4)①碘遇淀粉试液变蓝色,所以要用淀粉检验碘单质,故答案为:淀粉;
②达到滴定终点时,仰视滴定管读数偏大,则将使测定结果偏高,故答案为:偏高;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3~2Cu2+
2 2
cmol/L×V×10-3L cV×10-3mol
试样中CuCl2•2H2O的质量百分数=$\frac{cV×1{0}^{-3}mol×10×171g/mol}{mg}$×100%,
故答案为:$\frac{cV×1{0}^{-3}mol×10×171g/mol}{mg}$×100%;
(5)CuCl2•2H2O晶体受热时生成水,氯化铜水解生成氢氧化铜和HCl,所以要想得到晶体CuCl2,应该抑制氯化铜水解,HCl能抑制氯化铜水解,所以必须在干燥的HCl气流中加热脱水即可,故答案为:在干燥的HCl气流中加热脱水.
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作及实验分析能力,涉及物质分离和提纯、基本实验操作、滴定实验、盐类水解等知识点,易错点是滴定过程中误差分析.


科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌,锌作阳极 | |
| B. | 船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Br2+6KOH═5KBr+KBrO3+3H2O | |
| B. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑ | |
| C. | 2KNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2KNO2+O2↑ | |
| D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$ N2O↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
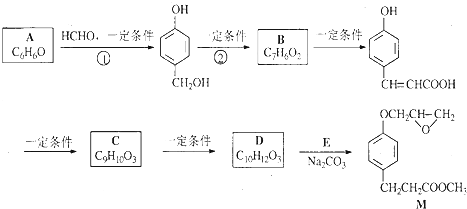
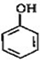 B
B C
C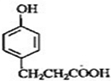
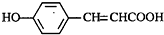 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.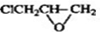 ,写出由D生成M的化学反应方程式
,写出由D生成M的化学反应方程式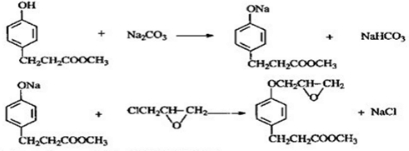 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
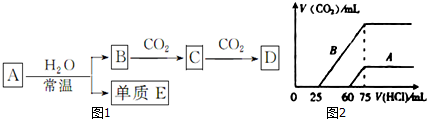
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
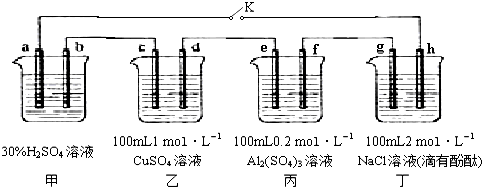
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=10V2 | B. | V1>10V2 | C. | V1<10V2 | D. | V2>10V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com