
分析 根据n=$\frac{m}{M}$计算K原子、O原子物质的量之比,设K2O2和KO2的物质的量分别为xmol、ymol,根据K原子、O原子数目之比列方程,整理可得二者物质的量之比.
解答 解:钾与氧的质量比为13:8,则K原子、O原子物质的量之比为$\frac{13}{39}$:$\frac{8}{16}$=2:3,设K2O2和KO2的物质的量分别为xmol、ymol,则(2x+y):(2x+2y)=2:3,整理可得x:y=1:2,
答:混合物中K2O2和KO2的物质的量之比为1:2.
点评 本题考查混合物有关计算,比较基础,侧重对物质的量的考查,也可以利用十字交叉法计算.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入KHSO4溶液 | B. | 向水中加入AlCl3溶液 | ||
| C. | 向水中加入Na2CO3溶液 | D. | 将水加热到100℃,使pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中可能含有一个醛基、一个羟基 | |
| B. | 分子中可能含有一个碳碳双键、两个羟基 | |
| C. | 六个碳原子可能连成环状 | |
| D. | 分子中可能含有一个羧基、一个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,A2转化率增大 | |
| B. | 升高温度有利于速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
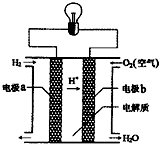
| A. | a电极是负极 | |
| B. | 该电池的总反应:2H2+O2═2H2O | |
| C. | 产物为无污染的水,属于环境友好电池 | |
| D. | 外电路中电子b电极通过导线流向a电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com