
分析 (1)0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,根据Kw=c(H+)×c(OH-)计算;
(2)混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等.
解答 解:(1)0.01mol/L的NaOH溶液的pH为11,则c(H+)=1×10-11mol/L,c(OH-)=0.01mol/L,Kw=c(H+)×c(OH-)=1×10-13,
答:水的离子积常数KW是1×10-13;
(2)①混合溶液呈中性,且硫酸和氢氧化钠都是强电解质,所以酸中氢离子物质的量和碱中氢氧根离子的物质的量相等,pH=a的NaOH溶液中氢氧根离子浓度=10 a-13 mol/L,pH=b的H2SO4溶液氢离子浓度=10-b mol/L,10 a-13 mol/L×VaL=10-b mol/L×VbL,且a=12,b=2,则Va:Vb=1:10,
答:Va:Vb为1:10;
②10 a-13 mol/L×VaL=10-b mol/L×VbL,且a+b=12,则Va:Vb=10:1,
答:Va:Vb为10:1.
点评 本题考查酸碱混合的计算,明确该温度下的Kw及pH与浓度的换算是解答本题的关键,注意酸碱反应的实质即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
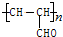 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
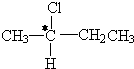 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.某链烃C7H10的众多同分异构体中:
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.某链烃C7H10的众多同分异构体中:
 、
、 .
.  .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时仰视容量瓶的刻度线 | |
| B. | 在用蒸馏水洗涤烧杯时,洗涤液未全部转移到容量瓶中 | |
| C. | 配制盐酸溶液用量筒量取浓盐酸时仰视刻度线 | |
| D. | 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 燃料电池总的离子反应方程式为:2Al+3HO2-═2AlO2-+2H2O | |
| B. | 电解时,Al消耗2.7g,则产生氮气的体积为1.12L | |
| C. | 电极b是负极,且反应后该电极区pH增大 | |
| D. | 电解过程中,电子的流向由a→d,c→b. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.6 |
| Mg(OH)2 | 9.8 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(Br2) | 苯 | 萃取、分液 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | CH4(C2H4) | 酸性高锰酸钾 | 洗气 |
| D | 硝基苯(硝酸) | 氢氧化钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com