
��֪
25��ʱ��A����Һ��pH��a��B����Һ��pH��b��(1)��AΪǿ�ᣬBΪǿ���a��b��14�����ߵ������Ϻ���Һ��pH��________����ʱ����Һ�м��������Ũ�ȴ������������Ũ�ȣ���ԭ�������________��
(2)��AΪǿ�ᣬBΪǿ����߰������Ϊ1��10��Ϻ���Һ�����ԣ���a��b��________��
(3)��A�Ļ�ѧʽΪHR��B�Ļ�ѧʽΪMOH����a��b��14�����ߵ������Ϻ���Һ�����ԣ�������Һ�бض���һ�������ܷ���ˮ�⣬������ˮ�ⷴӦ�����ӷ���ʽΪ________��
(4)��(3)�Ļ����Һ�У�������Ũ�ȴ�С��ϵһ����ȷ����________(�����)��
��c(MOH)��c(M+)��c(R��)��c(H+)��c(OH��)
��
c(HR)��c(M+)��c(R��)��c(OH��)��c(H+)��
c(R��)��c(M+)��c(H+)��c(OH��)��
c(M+)��c(R��)��c(OH��)��c(H+)��
c(M+)��c(H+)��c(R��)��c(OH��) ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
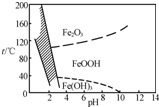 NiSO4?6H2O��һ����ɫ������ˮ�ľ��壬�㷺���ڻ�ѧ������������صȣ����ɵ�Ʒ������������⣬������Cu��Zn��Fe��Cr�����ʣ�Ϊԭ�ϻ�ã������������£�
NiSO4?6H2O��һ����ɫ������ˮ�ľ��壬�㷺���ڻ�ѧ������������صȣ����ɵ�Ʒ������������⣬������Cu��Zn��Fe��Cr�����ʣ�Ϊԭ�ϻ�ã������������£�| O | - 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
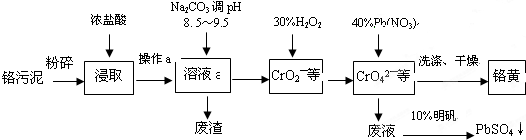
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| c2(SO3) |
| c2(SO2)?c(O2) |
| c2(SO3) |
| c2(SO2)?c(O2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
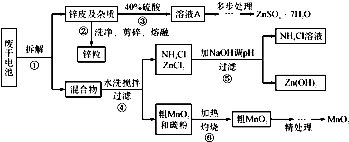
| NH3?H2O��Kb | Zn 2+��ȫ������pH | Zn��OH��2���ڼ��pH |
| 1.8��10-5 | 8.9 | ��11 |
| ||
| ||
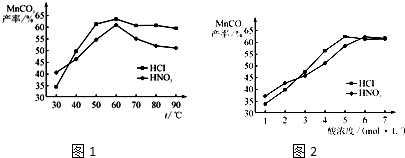
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2- 4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com