
| A、明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 |
| C、水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
| D、Li是最轻的金属,也是活动性强的金属,是制造电池的理想物质 |
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
| A、Al(OH)3、CaCO3都难溶,但溶解的部分都能完全电离 |
| B、复盐是纯净物,而混盐(如CaOCl2)是混合物 |
| C、弱电解质溶液中有溶质分子,但强电解质溶液中难以存在溶质分子 |
| D、电解质溶液能够导电,是因为通电使电解质电离产生了自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种溶液的pH不相同 |
| B、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
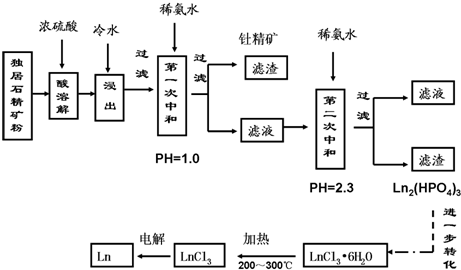
查看答案和解析>>
科目:高中化学 来源: 题型:
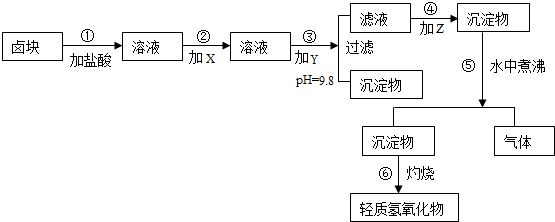
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含NaClO25.2%) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | H2O2(30%) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | NaOH(固98%) | 2100 | |
| Mg(OH)2 | 9.6 | 11.1 | Na2CO3(固95%) | 600 | |
| 卤块(MgCl2,30%) | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图Ⅰ表示增加反应物浓度对该平衡的影响 |
| B、图Ⅱ表示减小压强对该平衡的影响 |
| C、图Ⅲ表示温度对该平衡的影响,温度:乙>甲 |
| D、图Ⅳ表示催化剂对该平衡的影响,催化效率:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①②之间 | B、③④之间 |
| C、④⑤之间 | D、⑤⑥之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com