

| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为放热反应,热效应等于E 1-E 2 | |
| C. | 反应过程 a 有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于 E 1+E 2 |
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
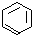 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质编号),HCHO分子的立体构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
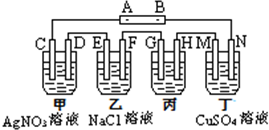
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的HNO 3与pH=11的KOH溶液 | |
| B. | pH=3的HNO 3与pH=11的氨水 | |
| C. | pH=3的H 2SO 4与pH=11的NaOH溶液 | |
| D. | pH=3的CH 3COOH与pH=11的Ba(OH) 2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CH2Cl2所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 常温常压下,16gO2和O3的混合气体含有的氧原子数为NA | |
| D. | 1molCaC2所含阴离子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com