
【题目】短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
①沸点:H2S>CH4
②酸性:H2SO3>H2CO3
③CS2中碳元素为+4价,硫元素为﹣2价
(2)羰基硫(COS)可作为一种熏蒸剂,其分子结构和CO2相似.羰基硫(COS)的电子式为 .
【答案】(1)③;
(2)![]() .
.
【解析】试题分析:(1)①沸点的高低与非金属性强弱无关;
②非金属强弱与最高价氧化物对应水化物的酸性强弱有关;
③CS2中碳元素为+4价,硫元素为﹣2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C;
(2)根据羰基硫分子中所有原子的最外层都满足8电子结构判断其电子式.
解:(1)①沸点的高低与非金属性强弱无关,故不选;
②非金属强弱与最高价氧化物对应水化物的酸性强弱有关,故不选;
③CS2中碳元素为+4价,硫元素为﹣2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故选;故答案为:③;
(2)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为![]() ,
,
故答案为:![]() .
.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
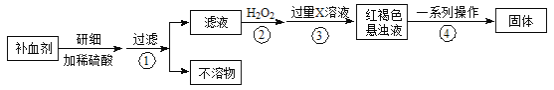
请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+
假设2:只有Fe3+
假设3: 。
(2)如何证明步骤①滤液中含有Fe2+ 。
(3)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、 、称量。
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定。
①用离子方程式表示该滴定原理:____________________
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需 。
重复滴定三次,消耗1.00 mol/L KMnO4标准溶液体积分别为19.98 mL、20.00 mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00 mL。请根据以上数据,再设计合理数据,完成下列实验过程的记录表格。(必须填满)
实验编号 | Fe2+溶液的 体积/mL | |||
1 | 20.00 | |||
2 | 20.00 | |||
3 | 20.00 |
③如何判断达到滴定终点:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 燃料的脱硫脱氮、SO2的回收利用和NOX的催化转化都是减少酸雨产生的措施
B. 用FeCl2溶液与铜反应制作印刷电路板
C. 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
D. 碳酸钠治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)选择合适的图像
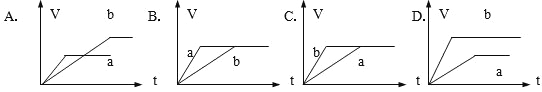
①将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是____________。
②将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是___________。
③将![]() 中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是____________。
中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是____________。
(2)用惰性电极电解400mL一定浓度的CuSO4溶液(不考虑电解过程中溶液体积的变化),通电一段时间后进行如下操作。
①如果向所得的溶液中加入0.1molCuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为 mol。
②如果向所得的溶液中加入0.1molCu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为 mol。
③如果向所得的溶液中加入0.1molCu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中一定能大量共存的是( )
A.使pH试纸呈蓝色的溶液中:I-、Cl-、NO3-、Cu2+
B.使酚酞呈深红色的溶液中:Na+、Cl- 、H+、NO3-
C.含大量Ag+ 的溶液中:K+、Na+、NO3-、SO42-
D.含大量OH- 的溶液中:CO32-、Cl-、F- 、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
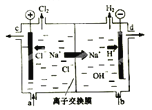
完成下列填空:
(1).写出电解饱和食盐水的离子方程式 。
(2).离子交换膜的作用为: 、 。
(3).精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4).KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.H2O2的电子式:![]()
B.铝离子的结构示意图:![]()
C.质子数为35、中子数为45的溴原子:![]() Br
Br
D.![]() C与
C与![]() C互为同素异形体
C互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是 .
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是 ,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是 mol.
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96L,则被还原的硝酸的物质的量是 mol,参加反应的硝酸的物质的量是 mol,产生的混合气体中NO和NO2体积比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com