
| A. | C3H7Cl | B. | C3H6 | C. | CH2Cl2 | D. | C4H6 |
分析 A、C3H7Cl是C3H8的一氯取代产物,根据C3H8中等效H原子判断;
B、含有4个碳原子或大于4个碳原子的烯烃,存在同分异构体;
C、CH2Cl2是甲烷的二氯取代产物,根据甲烷的空间结构判断;
D、含有4个碳原子或大于4个碳原子的炔烃,存在同分异构体.
解答 解:A、C3H7Cl是C3H8的一氯取代产物,C3H8中有2种H原子,所以C3H8的一氯取代产物有2种同分异构体,故A错误;
B、C3H6为丙烯,存在同分异构体,如环丙烷,故B错误;
C、CH2Cl2是甲烷的二氯取代产物,甲烷正四面体结构,CH2Cl2不存在同分异构体,故C正确;
D、C4H6为丁炔,存在同分异构体,如丁二烯或环烯等,故D错误.
故选C.
点评 本题考查同分异构体书写,难度不大,旨在考查学生对基础知识的理解与掌握.注意甲烷的卤代产物不存在同分异构体.


科目:高中化学 来源: 题型:选择题
| A. | TiO2是氧化剂 | |
| B. | 四氯化钛是还原产物 | |
| C. | Cl2发生氧化反应 | |
| D. | 氧化剂与还原剂的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
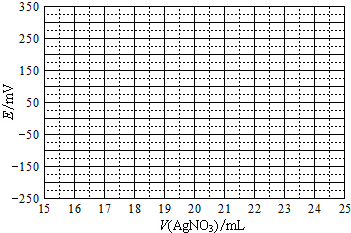
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2OH和H2 | B. | CH4和CH3CH2CH3 | ||
| C. | CH2═CH2和CH2═CH-CH3 | D. |  和H-C≡C-H 和H-C≡C-H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学只研究自然界中存在的物质 | |
| B. | 化学的特征是认识分子和制造分子 | |
| C. | 通过化学方法可以制造出使人长生不老的“仙丹” | |
| D. | 化学的研究层面越来越广,原子核的变化也已成为化学研究的范畴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH3)CH(C2H5)CH3的系统命名法的名称为2-甲基-3-乙基丁烷 | |
| B. | 乙炔的结构简式为CHCH,乙烯的球棍模型为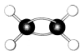 | |
| C. | 己烯和苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| D. | 向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com