
事实上,许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO4,2Na2O2+2SO3=2Na2SO4+O2,据此你认为下列反应方程式中不正确的是( )
A.Na2O2+N2O3=NaNO2+NaNO3
B.Na2O2+2NO2=2NaNO2+O2
C.Na2O2+N2O4=2NaNO3
D.2Na2O2+2Mn2O7=4NaMnO4+O2
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:选择题
用下列装置能达到有关实验目的的是( )
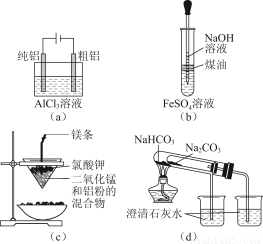
A.用图(a)装置电解精炼铝
B.用图(b)装置制备Fe(OH)2
C.图(c)装置只可制得金属钾
D.图(d)验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.金属钠在空气中燃烧的火焰呈黄色,是因为生成的Na2O2为淡黄色固体
B.铁丝在Cl2中燃烧有红棕色的烟,是因为生成的FeCl3为红棕色固体
C.过量的铁加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+
D.取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:填空题
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g 锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为( )
A.300 mL B.400 mL C.450 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:选择题
常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是( )

A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下列说法正确的是( )
①乙烯和甲烷可用溴的四氯化碳溶液鉴别 ②用溴水鉴别苯和正己烷 ③用灼烧的方法鉴别羊毛和蚕丝 ④在一定条件下,可用银氨溶液检验成熟苹果中是否含有葡萄糖
A.②④ B.①④ C.①② D.①③
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十六物质结构与性质练习卷(解析版) 题型:填空题
化学中的某些元素是与生命活动密不可分的元素。请回答下列问题:
(1)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式分别是________,NO3—的空间构型为____________。
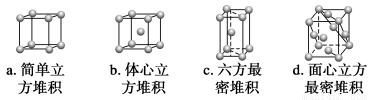
(2)A、B、C三元素的原子序数依次增大,它们原子的最外层电子排布均为4s1。
①B元素基态原子电子排布式为___________________________________________。
②A元素单质的晶体堆积模型为________(填字母),其空间利用率为__________。
③氢元素与C元素可形成一种红色化合物,其晶体结构单元如下图。则该化合物的化学式为__________(小白球表示H,小黑球表示C)。
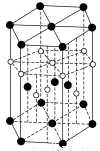
(3)已知氮化硼(BN)的一种晶体结构与金刚石相似,则B—N—B之间的夹角是________,氮化硼的密度为3.52 g·cm-3,则B—N键的键长是________pm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
某同学通过系列实验探究铝及其化合物的性质,操作正确且能达到目的的是( )
A.将浓氨水缓慢滴入Al2(SO4)3溶液中,观察Al(OH)3沉淀的生成和溶解
B.将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
C.将Al(OH)3沉淀转入蒸发皿中,加热至无水蒸气逸出,得氧化铝固体
D.向Al(OH)3沉淀中分别加入稀硫酸和NaOH溶液探究Al(OH)3的两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com