


 来计算.
来计算. +6×
+6× =4,
=4, ,离子化合物晶胞的边长为a cm,其体积为a3,
,离子化合物晶胞的边长为a cm,其体积为a3, 可知,ρ=
可知,ρ= =4×78 g?mol-1/NA a3cm3,故答案为:4×78 g?mol-1/NA a3cm3.
=4×78 g?mol-1/NA a3cm3,故答案为:4×78 g?mol-1/NA a3cm3.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解
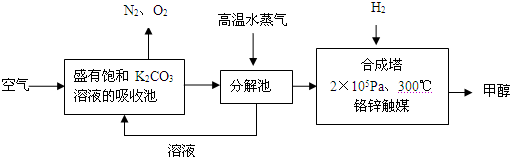
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| 18a |
| b |
| 18a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 主族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com