
| 71g |
| 71g/mol |
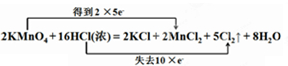 ,
, .
.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
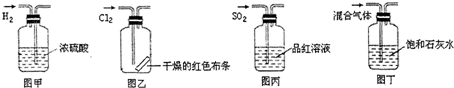
| A、图甲所示,可得到干燥的氢气 |
| B、图乙所示,可以验证氯气的漂白性 |
| C、图丙所示,可以验证SO2的漂白性 |
| D、图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B、铁和稀盐酸反应:Fe+2H+=H2↑+Fe2+ |
| C、氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ |
| D、钠投入水中:Na+H2O=Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3?H2O+H2O |
| B、氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+═Mg2++2NH3?H2O |
| C、硫化钠的水解:S2-+2H2O═H2S+2OH- |
| D、NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
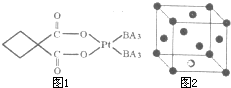 由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.
由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
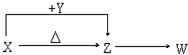 X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁片插入硝酸铜溶液Fe+Cu2+→Fe3++Cu |
| B、石灰石和盐酸反应CO32-+2H+→CO2↑+H2O |
| C、氢氧化镁与稀盐酸反应Mg(OH)2+2H+→Mg2++2H2O |
| D、硫酸与氢氧化钡溶液反应H++OH-→H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com