
【题目】铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途。
(1)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO 、OH 、FeO42、Cl 、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:________________________________。
②若反应过程中转移了 0.3mol 电子,则还原产物的物质的量为_______mol。
(2)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:
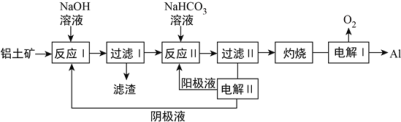
①滤渣主要成分为________。
②在实验室灼烧操作应选择的实验仪器为_________。
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式____________________________________。
(3)已知25 ℃时Ksp[Cu(OH)2]=2.2×1020,Ksp[Al(OH)3]=1.1×1033。在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成_________沉淀(填化学式)。
(4)以含有少量硫酸的硫酸铜溶液为原料制备铜:a g铁粉与上述溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为___________。
【答案】2Fe(OH)3+3ClO +4OH =2FeO42+3Cl+5H2O 0.15 Fe2O3 坩埚 HCO3-+OH-=H2O+CO32- Al(OH)3 7:1
【解析】
(1)①湿法制备高铁酸钾(K2FeO4),则FeO42为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO为反应物,Cl为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42的系数为2,ClO的系数为3,Cl的系数为3,根据电荷守恒可知,OH为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,离子方程式为:2Fe(OH)3+3ClO+4OH=2FeO42+3Cl+5H2O,
故答案为:2Fe(OH)3+3ClO+4OH=2FeO42+3Cl+5H2O;
②反应中Fe元素化合价变化由+3价升高为+6,故每生成1molFeO42转移电子1mol×(63)=3mol,由于还原产物为Cl,若反应过程中转移了0.3mol电子,则还原产物的物质的量为![]() =0.15mol,
=0.15mol,
故答案为:0.15mol.
(2)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝,由流程可知,加NaOH溶解时Fe2O3不反应,由信息可知SiO2在“碱溶”时转化为铝硅酸钠沉淀,过滤得到的滤渣为Fe2O3;碳酸氢钠与偏铝酸钠反应生成Al(OH)3,过滤II得到Al(OH)3,灼烧生成氧化铝,电解I为电解氧化铝生成Al和氧气,电解II为电解Na2CO3溶液,结合图可知,阳极上碳酸根离子失去电子生成碳酸氢根离子和氧气,阴极上氢离子得到电子生成氢气,
①根据分析可知,滤渣的主要成分为Fe2O3,故答案为:Fe2O3;
②灼烧氢氧化铝固体需要在坩埚中进行,故答案为:坩埚;
③在溶解铝土矿时加入了过量的氢氧化钠溶液,则加入少量碳酸氢钠时,碳酸氢钠优先于氢氧化钠反应,该反应的离子方程式为:HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
(3)在25℃下,向浓度均为0.1moL1的AlCl3和CuCl2混合溶液中逐滴加入氨水,由Ksp[Cu(OH)2]=2.2×1020,可知c(OH)=![]() =4.47×1010mol/L,由Ksp[Al(OH)3]
=4.47×1010mol/L,由Ksp[Al(OH)3]
=1.1×1033可知需要c(OH)=![]() =2.2×1011mol/L,铝离子转化为沉淀需要的c(OH)小,则Al(OH)3先沉淀,故答案为:Al(OH)3;
=2.2×1011mol/L,铝离子转化为沉淀需要的c(OH)小,则Al(OH)3先沉淀,故答案为:Al(OH)3;
(4)得到Cu的质量与Fe的质量相等,说明Fe与硫酸铜反应中固体增重等于与硫酸反应的Fe的质量,令与硫酸反应的Fe的质量为56g,则:
Fe+CuSO4═FeSO4+Cu 固体增重
1mol 64g-56g=8g
n(CuSO4) 56g
故n(CuSO4)= ![]() =7mol
=7mol
Fe+H2SO4═FeSO4+H2↑
56g 1mol
故参加反应的硫酸铜与硫酸的物质的量之比=7mol:1mol=7:1;
答案为:7:1


科目:高中化学 来源: 题型:
【题目】已知3X(g)+Y(g) ![]() W(g)+2M(g) ΔH=-akJ/mol(a﹥0)。一定温度下,在体积恒定的密闭容器中,加入3mol X(g)与1mol Y(g),下列说法正确的是( )
W(g)+2M(g) ΔH=-akJ/mol(a﹥0)。一定温度下,在体积恒定的密闭容器中,加入3mol X(g)与1mol Y(g),下列说法正确的是( )
A. 充分反应后,放出热量为akJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为3∶1
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某有机物的分子式为C6H12,若其分子中所有碳原子一定处于同一平面,则该有机物的结构简式为________;若该有机物有一个顺式异构体,且能与氢气加成生成2-甲基戊烷,则该顺式异构体的结构简式为___________。
Ⅱ、玫瑰的香味物质中包含苧烯,苧烯的键线式为![]() 。苧烯的分子式为________。有机物A是苧烯的同分异构体,分子中含有
。苧烯的分子式为________。有机物A是苧烯的同分异构体,分子中含有![]() 结构,A可能的结构为____(用键线式表示)。
结构,A可能的结构为____(用键线式表示)。
Ⅲ、某物质的分子式为C7H6O2 ,其同分异构体既能发生银镜反应,又能与FeCl3溶液发生显色反应,写出符合上述条件的同分异构体的结构简式________________。
通过此题的解答,请归纳你在书写同分异构体时应用的规律_______ 、 _______ 、 _______(至少两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应 10NaN3+2KNO3 =K2O+5X+16N2↑,下列说 法不正确的是( )
A.X 的化学式为 Na2O
B.上述反应中 NaN3 被氧化,KNO3 发生还原反应
C.每生成 1.6molN2,则转移的电子为 3 mol
D.若被氧化的 N 原子的物质的量为 3mol,则氧化产物比还原产物多 1.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是
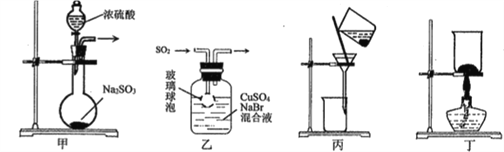
A. 用装置甲制取SO2 B. 用装置乙制取CuBr
C. 用装置丙避光将CuBr与母液分离 D. 用装置丁干燥CuBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
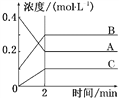
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.1mol![]() 气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法错误的是
气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法错误的是
A. 压缩容器,颜色加深
B. 在平衡时体系内含![]() 0.04mol
0.04mol
C. 以![]() 的浓度变化表示的平均反应速率为0.001mol/(L·s)
的浓度变化表示的平均反应速率为0.001mol/(L·s)
D. 平衡时,如果再充入一定量![]() ,则可提高
,则可提高![]() 的转化率
的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50mL KMnO4标准溶液的过程示意图。
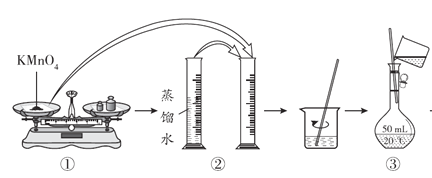
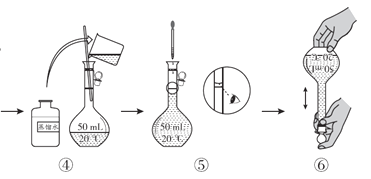
(1)请你观察图示判断,其中不正确的操作有__________(填序号)。
(2)如果用图示的操作配制溶液,所配制的溶液浓度将__________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)已知草酸跟KMnO4溶液反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mnx++10CO2↑+8H2O则方程式中的x=__________。
(4)经过计算,血液样品中Ca2+的浓度为__________mg·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com