
在a g环已烷,乙醛,葡萄糖,甲酸甲酯的混合物中,已知氧元素的质量分数为b,则碳元素的质量分数是( )
|
| A. | 1﹣b | B. |
|
|
| C. |
| D. | 数据不全无法计算 |
考点:
元素质量分数的计算.
专题:
计算题.
分析:
环己烷为C6H12,乙醛为C2H4O,葡萄糖为C6H12O6,甲酸甲酯为C2H4O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氧元素的质量发生计算混合物中碳元素与氢元素的质量分数之和,再根据碳元素与氢元素质量关系计算.
解答:
解:环己烷为C6H12,乙醛为C2H4O,葡萄糖为C6H12O6,甲酸甲酯为C2H4O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,混合物中氧的质量分数为b,则混合物中碳元素与氢元素的质量分数之和为1﹣b,故混合物中氢元素的质量分数=(1﹣b)×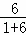 =
=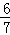 (1﹣b),
(1﹣b),
故选C.
点评:
本题考查混合物中元素的质量分数的计算,关键是根据各成分的化学式确定C、H的质量定比关系,学生应学会利用定组成的方法来解答混合物中元素的质量分数计算.


科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 |
|
| B. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等 |
|
| C. | 将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成 |
|
| D. | 除FeCl2溶液中的少量FeCl3,可用加入足量铁屑过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述中,错误的是( )
|
| A. | 其水溶液显弱酸性,俗称石炭酸 |
|
| B. | 苯酚溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 |
|
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 |
|
| D. | 在碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物的结构片段如下:
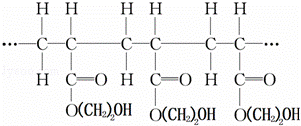
下列分析正确的是( )
|
| A. | 它是缩聚反应的产物 |
|
| B. | 其单体是CH2=CH2COOH和HOCH2CH2OH |
|
| C. | 其链节是CH3CH2COO(CH2)2OH |
|
| D. | 其单体是CH2=CHCOO(CH2)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍.一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团.且B的核磁共振氢谱显示有3组不同的峰.
(1)A的分子式是 .
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是 (填序号).
A.C5H12O3 B.C4H10 C.C6H10O4 D.C5H10O
(3)①B的结构简式是 .
②A不能发生的反应是 (填序号).
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: .
(5)写出B与乙二酸发生缩聚反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则图中右侧Y形管中放置的药品组合不符合要求的是(必要是可以加热)( )
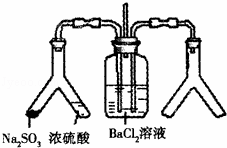
A. Cu和浓硝酸 B. CaO和浓氨水
C. 大理石和稀盐酸 D. 高锰酸钾溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,发生下列几种反应①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O ②Cl2+2NaBr=2NaCl+Br2 ③Br2+2FeBr2=2FeBr3根据上述反应,下列结论正确的是( )
A. 还原性强弱顺序为:Br﹣>Fe2+>Cl﹣
B. 氧化性强弱顺序为:MnO4﹣>Cl2>Br2>Fe3+
C. 反应①中,当生成1mol Cl2时,被氧化的HCl为3.2mol
D. 溶液中可发生反应:2Fe3++2Cl﹣=2Fe2++Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为 ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 .
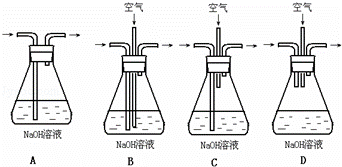
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10﹣5mol•L﹣1,就认为沉淀完全),然后过滤、浓缩、结晶.
已知:Ksp≈10﹣22,Ksp≈10﹣16,Ksp≈10﹣38
请回答下列问题:
如开始加入的铜粉为3.2g,最后所得溶液为500mL,溶液中含有铁元素0.005mol.
①方案1中的B仪器名称是 .
②为了使铁元素全部沉淀,应调节pH至少为 .
③方案2中甲物质可选用的是 .
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 .
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL 1.5mol•L﹣1的稀硫酸中,控温在50℃.加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O 10.5g.
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4•5H2O的产率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com