
| A. | 硫酸的氢离子浓度大于盐酸 | |
| B. | pH值越大,酸性越强 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 酸性溶液中氢离子浓度一定大于氢氧根离子浓度 |
分析 A.盐酸、硫酸的浓度未知,硫酸为二元酸;
B.pH越小,酸性越强;
C.常温下pH=7的溶液呈中性;
D.氢离子浓度与氢氧根离子浓度的相对大小可确定溶液的酸碱性.
解答 解:A.盐酸、硫酸的浓度未知,不能比较氢离子的浓度,若等浓度时,硫酸的氢离子浓度大于盐酸,故A错误;
B.pH越小,酸性越强,pH值越大,碱性越强,故B错误;
C.常温下pH=7的溶液呈中性,温度未知,不能确定pH=7的溶液是否为中性,故C错误;
D.氢离子浓度与氢氧根离子浓度的相对大小可确定溶液的酸碱性,则酸性溶液中氢离子浓度一定大于氢氧根离子浓度,故D正确;
故选D.
点评 本题考查溶液酸碱性的判断,为高频考点,把握氢离子浓度、酸碱性判断为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是Ca(ClO)2,应密封保存 | |
| B. | 紫色石蕊试液中通入过量二氧化硫气体,溶液将先变红后褪色 | |
| C. | 加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| D. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是二氧化硅 | |
| B. | 水玻璃是硅酸钠的俗称 | |
| C. | 单质硅是一种重要的半导体材料 | |
| D. | 二氧化硅能与氧化钙反应生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
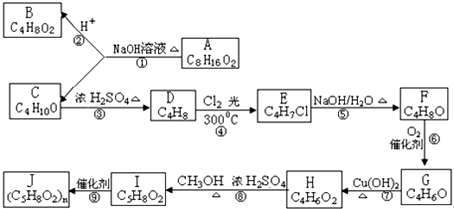
 ;⑨的化学反应方程式
;⑨的化学反应方程式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com