
| A. | 次氯酸的电子式: | B. | 硫原子的价电子排布式:3s23p4 | ||
| C. | 氮化硅的分子式:Si4N3 | D. | N原子的电子排布图为: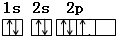 |
分析 A.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
B.硫原子的最外层含有6个电子,价电子数为6;
C.氮化硅晶体为原子晶体,不存在氮化硅分子;
D.N原子核外有7个电子,分别位于1S、2S、2P轨道,处于2p能级上的3个电子应尽可能分占3个不同2p原子轨道,且自旋状态相同,因此违背了洪特规则.
解答 解:A.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为: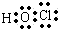 ,故A错误;
,故A错误;
B.硫原子为ⅥA族元素,其价电子排布式为:3s23p4,故B正确;
C.Si4N3为氮化硅的化学式,不是分子式,故C错误;
D.N原子核外有7个电子,分别位于1S、2S、2P轨道,其轨道表示式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、价电子排布式、分子式、电子排布图等知识,明确常见化学用语的书写原则为解答关键,C为易错点,注意氮化硅为原子晶体,不存在二氧化硅分子.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |
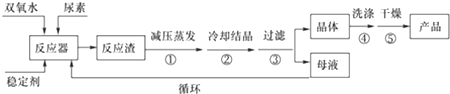
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液中,可能含有下表所列离子中的某几种:
某溶液中,可能含有下表所列离子中的某几种:| 阳离子 | Al3+、Mg2+、NH4+、Na+ |
| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池放电时负极质量增加 | |
| C. | 该电解池的阴极反应为:2 NO3-+6H2O+10e-═N2↑+2OH- | |
| D. | 若电路中流过2mol电子,则阳极室溶液质量减少32g(忽略气体的溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51.2% | B. | 36.8% | C. | 41.5% | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com