
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
分析 A.钢铁腐蚀常在中性溶液中进行;
B.碳酸钠溶液呈碱性,有利于油脂的水解;
C.明矾不具有杀菌消毒能力;
D.光导纤维为无机物.
解答 解:A.自然界中钢铁的表面易形成弱酸性或中性环境,易发生吸氧腐蚀,所以钢铁的腐蚀以吸氧腐蚀为主,故A错误;
B.碳酸钠为强碱弱酸盐,溶液呈碱性,有利于油脂的水解,故B正确;
C.明矾不具有杀菌消毒能力,只能用于净水,除去水中的悬浮物,故C错误;
D.光导纤维为无机物,不是有机高分子材料,故D错误;
故选B.
点评 本题综合考查物质的性质以及应用,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意把握常见物质的性质与用途的关系,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 ≡C-CH3的分子结构,下列说法正确的是( )
≡C-CH3的分子结构,下列说法正确的是( )| A. | 除苯环外的其余碳原子有可能都在一条直线上 | |
| B. | 除苯环外的其余碳原子不可能都在一条直线上 | |
| C. | 12个碳原子不可能都在同一平面上 | |
| D. | 所有原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g分子式为CnH2n的烃中含有的C-H键的数目为2NA | |
| B. | 2.24 L(标准状况)甲烷与7.1 g氯气在光照条件下反应得到CH3Cl的分子数为0.1NA | |
| C. | 含有10.7 g Fe(OH)3的氢氧化铁胶体中,氢氧化铁胶粒总数为0.1NA | |
| D. | 100g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
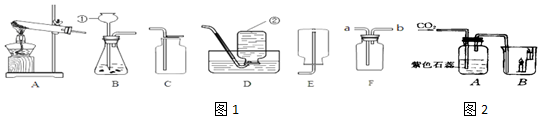
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①中Cu2S、Cu2O只作还原剂 | |
| B. | ①中每生成11.2 L气体(标准状况)转移3 mol原子 | |
| C. | 由反应②可知,在相同条件下的氧化性强弱顺序为:Zn2+>Mn2+>H+ | |
| D. | ②中阳极的电极反应式为:Mn2++2H2O-2e-═MnO2+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
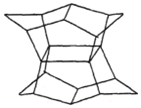 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )| A. | 分子式为C20H20 | B. | 一氯代物的同分异构体只有两种 | ||
| C. | 分子中含有4个亚甲基(-CH2-) | D. | 分子中含有12个五元碳环 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
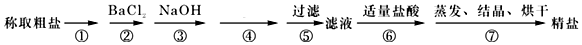
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 晶体硅 | S |
| C | CH3COONa | 水晶 |  |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com