A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,A的核外电子数等于其电子层数,B的最外层电子数是次外层电子数的3倍,A和C、B和E同主族,B、C、D的离子具有相同的电子层结构,D的离子是同周期中离子半径最小的,F原子中共有6个未成对电子.
请回答下列问题:
(1)写出下列元素的元素符号:A______、C______、E______、F______.
(2)元素A和元素B可以形成A2B物质甲,写出甲的分子式______,甲为______(填“极性”或“非极性”)分子.
(3)元素A和元素E形成化合物乙,用电子式表示化合物乙______;常温下甲为液态,乙为气态,试解释原因______.
(4)元素A与元素C形成化合物丙,丙的水溶液显碱性,试用化学方程式解释其原因:______.
(5)元素C、元素D的最高价氧化物的水化物相互反应的离子方程式是______.
(6)写出元素F的外围电子排布式______.
【答案】
分析:A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,B的最外层电子数是次外层电子数的3倍,则B原子有2个电子层,最外层电子数为6,则B为氧元素;B和E同主族,则E为硫元素;B、C、D的离子具有相同的电子层结构,则核外电子数为10,A和C同主族,A的核外电子数等于其电子层数,则A原子含有1个电子层,为H元素,故C为Na元素;D的离子是同周期中离子半径最小的,则D为Al元素;F原子中共有6个未成对电子,处于第四周期,外围电子排布为3d
54s
1,为Cr元素,据此解答.
解答:解:A、B、C、D、E、F均为前四周期的元素,原子序数依次增大,B的最外层电子数是次外层电子数的3倍,则B原子有2个电子层,最外层电子数为6,则B为氧元素;B和E同主族,则E为硫元素;B、C、D的离子具有相同的电子层结构,则核外电子数为10,A和C同主族,A的核外电子数等于其电子层数,则A原子含有1个电子层,为H元素,故C为Na元素;D的离子是同周期中离子半径最小的,则D为Al元素;F原子中共有6个未成对电子,处于第四周期,外围电子排布为3d
54s
1,为Cr元素,
(1)由上述分析可知:A为H、C为Na、E为S、F为Cr,
故答案为:H、Na、S、Cr;
(2)元素A和元素B可以形成A
2B物质甲为H
2O,分子为V形结构,正负电荷重心不重合,为极性分子;
故答案为:H
2O;极性;
(3)元素A和元素E形成化合物乙为H
2S,分子中氢原子与硫原子之间形成1对共用电子对,电子式为
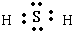
,甲分子间存在氢键,乙分子间无氢键,常温下甲为液态,乙为气态,
故答案为:
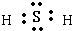
;甲分子间存在氢键,乙分子间无氢键;
(4)元素A与元素C形成化合物丙为NaH,NaH与水反应:NaH+H
2O=NaOH+H
2↑,生成NaOH,其水溶液显碱性,故答案为:NaH+H
2O=NaOH+H
2↑;
(5)元素C、元素D的最高价氧化物的水化物分别为Al(OH)
3、NaOH,相互反应的离子方程式是Al(OH)
3+OH
-=AlO
2-+2H
2O,
故答案为:Al(OH)
3+OH
-=AlO
2-+2H
2O;
(6)F为Cr元素,原子外围电子排布为3d
54s
1,
故答案为:3d
54s
1.
点评:本题考查结构性质位置关系,涉及常用化学用语、氢键、分子结构与性质、核外电子排布规律、元素化合物性质等,难度中等,推断元素涉及解题关键,是对学生综合能力的考查.

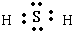 ,甲分子间存在氢键,乙分子间无氢键,常温下甲为液态,乙为气态,
,甲分子间存在氢键,乙分子间无氢键,常温下甲为液态,乙为气态,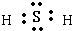 ;甲分子间存在氢键,乙分子间无氢键;
;甲分子间存在氢键,乙分子间无氢键;

 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.