
【题目】某研究性实验小组欲验证浓硝酸在与Cu、Ag 合金的反应过程中除生成NO2气体外,还会有少量NO生成。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装器。
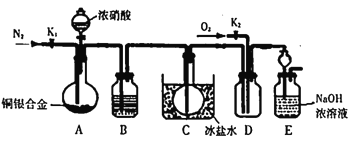
请回答下列问题
(1)写出A中银与HNO3反应时所有可能的离子方程式_____________________。
(2)实验开始时,打开分液漏斗前要先打开活塞______( 填“K1”或“K2”),其目的是___________。
(3)装置中B瓶选用的试剂______________。
a.H2O b.浓硫酸 c.NaOH 熔液
(4)装置E中长颈漏斗的作用____________。
(5)反应停止后,欲想证明有NO生成,需要怎样操作:__________,当出现何种现象说明有NO生成____________。
【答案】 Ag+2H++NO3-=Ag++NO2↑+H2O 3Ag+4H++NO3-=3Ag++NO↑+2H2O K1 把装置中空气赶走,防止NO被氧化 b 防止倒吸 打开D中的活塞K2并通入O2 D中无色气体变成红棕色
【解析】(1)银和浓硝酸反应生成二氧化氮、硝酸银和水,随着反应的进行,硝酸浓度变稀,银和稀硝酸反应生成一氧化氮气体,硝酸银和水,反应的可能化学方程式为Ag+2H++NO3-=Ag++NO2↑+H2O、3Ag+4H++NO3-=3Ag++NO↑+2H2O;(2)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;因此实验开始时,打开分液漏斗前要先打开活塞K1,其目的是把装置中空气赶走,防止NO被氧化;(3)B装置是吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,所用试剂是浓硫酸,答案选b;(4)由于氢氧化钠吸收尾气时可能会发生倒吸现象,所以装置E中长颈漏斗的作用是防止倒吸;(5)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色二氧化氮气体。


科目:高中化学 来源: 题型:
【题目】图为①⑥六种烃分子的模型(小黑球代表碳原子,短线代表共价键,氢原子省略)下列说法中不正确的是( ) 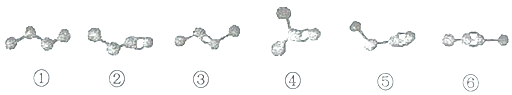
A.烃②、③、④的分子式均为C4H8 , 三者互为同分异构体
B.烃⑤和⑥的分子式均为C4H6 , 二者互为同分异构体
C.烃②、③、⑤、⑥分别与足量氧气发生加成反应,均可得到烃①
D.等物质的量的烃②和⑤分别在氧气中完全燃烧,烃⑤消耗的氧气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物 ![]() (W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图:
(W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图: 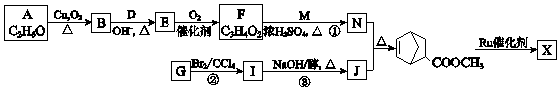
已知:
i.R1CHO+R2CH2CHO ![]()
![]()
ii. ![]()
iii.R1CH=CHR2+R3CH=CHR4 ![]() R1CH=CHR4+R3CH=CHR2
R1CH=CHR4+R3CH=CHR2
(R代表烃基或氢原子)
(1)A的结构简式是 .
(2)B所含的官能团名称是 .
(3)E的结构简式是 .
(4)①的化学方程式是 .
(5)②的反应类型是 .
(6)J是五元环状化合物,③的化学方程式是 .
(7)X的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种
阳离子 | H+、Na+、Al3+、Fe3+、NH4+、Mg2+ |
阴离子 | OH-、CO32-、SiO32-、AlO2-、Cl- |
现取适量该溶液,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示:
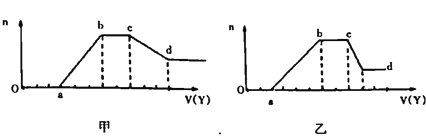
(1)若Y是盐酸,所得到的关系图如甲图所示,则X中一定含有的阴离子是______,X中一定存在的几种阴离子物质的量之比为____(按题干表格中阴离子出现的顺序写比例顺序);ab段发生反应的离子方程式为_________________;cd段发生的反应的离子方程式为______________。
(2)若Y是NaOH溶液,所得到的关系图如乙用所示,X中一定含有的阳离子是_______;ab段发生反应的离子________________;bc段发生反应的离子为________________;cd段发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列反应的离子方程式正确的是( )
A.用铂作电极电解MgCl2溶液:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
B.以铜做电极电解硫酸铜溶液:2Cu2++2H2O ![]() 4H++2Cu+O2↑
4H++2Cu+O2↑
C.甲烷/KOH燃料电池正极反应:O2+4H++4e﹣═2H2O
D.高铁电池 3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O
3Zn(OH)2+2Fe(OH)3+4KOH充电时的阳极反应:Fe(OH)3﹣3e﹣+5 OH﹣═FeO42﹣+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式为: 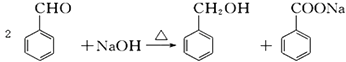
某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理: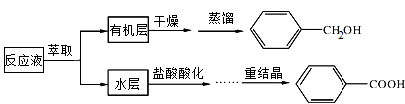
重结晶过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小.
请根据以上信息,回答下列问题:
(1)分离苯甲醇与苯甲酸钠时,合适的萃取剂是 , 简述从分液漏斗中取出上层溶液的方法 . 萃取分液后,所得水层用盐酸酸化的目的是 .
(2)苯甲酸在A,B,C三种溶剂中的溶解度(s)随温度变化的曲线如图所示: 
重结晶时,合适的溶剂是 , 重结晶过程中,趁热过滤的作用是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙由如下反应制得:C4H10O ![]() C4H8
C4H8 ![]() C4H8Br2(丙),丙的结构简式不可能是( )
C4H8Br2(丙),丙的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.(CH3)2CBrCH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com