
(8分)
某些化学反应可用下式表示A+B→→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A、C均含有铝元素。①当B是盐酸时,C是 ;
②当B是NaOH时,C是 。
(1)Cl2+2OH-=Cl-+ClO-+H2O ; (2)C、浓H2SO4; (3)AlCl3、NaAlO2
【解析】
试题分析:(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,则满足该反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O ; 若C、D均为气体且都能使澄清石灰水变浑浊,则发生的反应为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O ,A与B的组合是C、浓H2SO4; (3)若A、C均含有铝元素。①当B是盐酸时,则发生反应:NaAlO2+4HCl=NaCl+AlCl3+2H2O。则C是AlCl3。②当B是NaOH时,发生反应: AlCl3+4NaOH= NaAlO2+ NaCl+2H2O。C是NaAlO2.
CO2↑+2SO2↑+2H2O ,A与B的组合是C、浓H2SO4; (3)若A、C均含有铝元素。①当B是盐酸时,则发生反应:NaAlO2+4HCl=NaCl+AlCl3+2H2O。则C是AlCl3。②当B是NaOH时,发生反应: AlCl3+4NaOH= NaAlO2+ NaCl+2H2O。C是NaAlO2.
考点:考查元素及化合物的推断及相互转化的关系的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014山东省淄博市高三二模理综化学试卷(解析版) 题型:填空题
(17分)降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)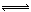 CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化如下表所示。
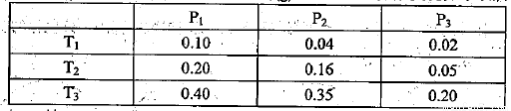
则Pl P3(填“>”“<”或“=”,下同)。若T1、Pl,T3、P3时平衡常数分别为K1、K3,
则K1 K3。T1、Pl时H2的平衡转化率为 。
②一定条件下,t上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是____ 。
A.反应物的浓度降低 B.容器内压强增大
C.正反应速率大于逆反应速率 D.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,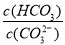 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
A.c(K+)=2c(CO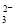 )+c(HCO
)+c(HCO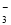 )+c(H2CO3)
)+c(H2CO3)
b.c(HCO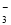 )
)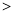 c(CO
c(CO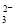 )
)
c.降低温度,c(H+)·c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高一5月质量检测化学试卷(解析版) 题型:选择题
100 mL 2 mol/L H2SO4 与过量Zn粉反应,在一定温度下,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是( )
A.加入碳酸钠固体 B.改用18 mol/L的浓H2SO4
C.滴入少量硫酸铜溶液 D.加入硫酸钾溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高二化学试卷(解析版) 题型:选择题
某高聚物结构简式  ,则其单体不可能为( )
,则其单体不可能为( )
A、CH2=CHCH3 B、CH2=C(CH3)2
 C、CH2=CH2 D、CH2=C-CH2CH3
C、CH2=CH2 D、CH2=C-CH2CH3
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高二化学试卷(解析版) 题型:选择题
下列化学用语中,书写或说法正确的是( )
A.硝基苯的结构简式: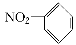 B.乙醇含有的官能团是—OH,带一个单位负电荷
B.乙醇含有的官能团是—OH,带一个单位负电荷
C.丙烷的球棍模型为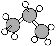 D.乙酸的分子式:C2H4O
D.乙酸的分子式:C2H4O
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:选择题
用下列实验装置能达到实验目的的是( )
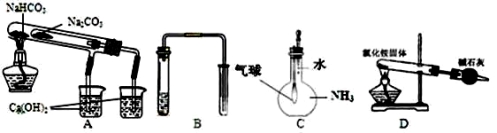
A.比较NaHCO3和Na2CO3热稳定性大小 B.用铜和稀硝酸制取并收集少量NO
C.验证氨气在水中溶解度的大小 D.实验室用氯化铵制少量氨气
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市3月质量检测高一化学试卷(解析版) 题型:选择题
下列物质属于分子晶体的是( )
A.熔点是1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液态不导电,水溶液能导电
C.能溶于水,熔点812.8℃,沸点是1446℃
D.熔点是97.80℃,质软、导电,密度是0.97g/cm3
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济宁市高二年级第二学期阶段考试化学试卷(解析版) 题型:选择题
0.lmol/L的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.lmol/L。如果要使c(CO32-)更接近于0.lmol/L,可以采取的措施是( )
A.加入少量盐酸 B.加入适量的水 C.加入适量的KOH D.加热
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:实验题
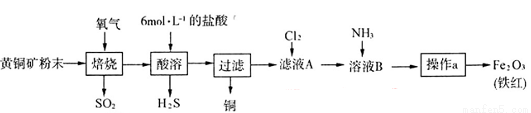
(19分)黄铜矿的主要成分是CuFeS2(硫元素显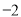 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
已知:

 =
=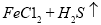
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。

(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。
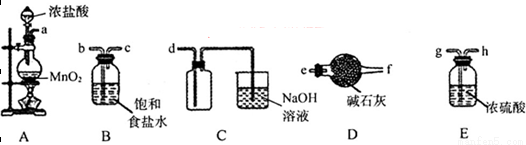
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com