
有关甲烷和乙烷的说法中,错误的是( )
|
| A. | 互为同系物 |
|
| B. | 均不能使高锰酸钾酸性溶液褪色 |
|
| C. | 在核磁共振氢谱图(1H核磁共振谱图)中,均只有1个吸收峰 |
|
| D. | 二氯取代物均为两种 |
| 烷烃及其命名. | |
| 专题: | 有机化学基础. |
| 分析: | A.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物; B.烷烃性质较稳定; C.分子中有几种氢原子,核磁共振氢谱就有几种峰; D.甲烷是正四面体结构. |
| 解答: | 解:A.甲烷和乙烷都是烷烃在分子组成上相差一个CH2原子团,互为同系物,故A正确; B.烷烃性质较稳定,均不能使高锰酸钾酸性溶液褪色,故B正确; C.甲烷和乙烷都只含1种氢原子,核磁共振氢谱均只有1个吸收峰,故C正确; D.甲烷是正四面体结构,二氯代物只有一种,故D错误. 故选D. |
| 点评: | 本题考查有机物的结构与性质,把握结构与性质的关系为解答的关键,题目难度不大. |


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)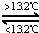 Sn(s,白)△H3=+2.1kJ•mol﹣1,
Sn(s,白)△H3=+2.1kJ•mol﹣1,
下列说法正确的是( )
|
| A. | △H1>△H2 |
|
| B. | 锡在常温下以灰锡状态存在 |
|
| C. | 灰锡转为白锡的反应是放热反应 |
|
| D. | 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动性相对强弱的系列实验。试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是 。
甲同学的设计思路是 。
(2)乙同学接着甲的实验,向烧杯中滴加 溶液,进而观察到的现象
是 。
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是 。
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂 溶液(作为电解液)。反应在调控下随即开始,实验中有关反应的化学方程式为 。实验中的明显现象是 。
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是( )
|
| A. | 氯化钠的电子式:Na: |
|
| B. | 乙烯的结构简式:C2H4 |
|
| C. | 硅的原子结构示意图: |
|
| D. | 硫酸的电离方程式:H2SO4=H22++SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报.
①下列行为不会增加城市大气中PM2.5浓度的是 (填字母).
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒.感冒发烧病人可服用 药品进行治疗(填字母).
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力.维生素C的结构简式是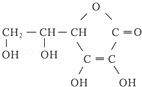 ,它的分子式是 .在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性.
,它的分子式是 .在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,浓度均为0.1mol•L﹣1的4种钠盐溶液pH如下表:下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 8.3 | 5.2 |
|
| A. | 足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO﹣=HClO+HSO3﹣ |
|
| B. | 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
|
| C. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
|
| D. | NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3﹣)>c(SO32﹣)>c(OH﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
②锰酸钾
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是______________;
实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为_______。
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 : ;
其中氧化还原反应中氧化剂和还原剂的质量比为_________________________。
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
 (4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低。有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。
图中A口加入的溶液最好为__________。
使用阳离子交换膜可以提高Mn元素利用率的原因为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C.101 kPa时,2H2(g)+O2(g)====2H2O(g) ΔH=-483.6 kJ·mol-1, H2的燃烧热为241.8 kJ·mol-1
D.H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com