
【题目】某气体X可能由氢气、一氧化碳、甲烷中的一种或几种组成,将X燃烧,把燃烧后生成的气体通过如图所示的A、B两个洗气瓶,试回答:
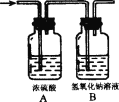
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则X气体是(填化学式,下同).________。
(2)若A、B两个洗气瓶的质量都增加,则X气体可能的组合是(每空填一种组合):①________, ②________,③________,④________, ⑤________。
【答案】H2 CH4 H2、CO CO、CH4 CH4、H2 CH4、CO、H2
【解析】
A装置的作用是吸收水蒸气,B装置的作用是检验并吸收二氧化碳气体,氢气燃烧生成水,一氧化碳燃烧生成二氧化碳,甲烷燃烧生成水和二氧化碳,根据生成水和二氧化碳的质量就可以判断X气体的组成。
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,说明X燃烧后只生成水,那么X气体就是氢气;
(2)若A、 B两个洗气瓶的质量都增加,说明同时生成了水和二氧化碳,那么X气体的组成情况就有以下几种可能:①CH4、H2;②CO、H2;③CH4、H2、CO;④CH4;⑤CH4、CO等(序号顺序可随意颠倒,组合符合题意即可)。


科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________________。
(2)A和D可形成化合物的化学式为________。
(3)B元素在周期表中的位置为_____________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)__________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为______,若将该反应设计成原电池,原电池的负极材料为___________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为____,能够用于漂白的固体物质中阴、阳离子个数比为_________________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是![]()
![]()
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气体的摩尔质量越小,扩散速度越快。图所示为气体扩散速度的实验。两种气体扩散时形成图示的白色烟环。对甲、乙物质的判断,正确的是

A.甲是浓氨水,乙是浓硫酸
B.甲是浓氨水,乙是浓盐酸
C.甲是氢氧化钠溶液,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验在氢气和二氧化碳的混合气体中是否混入了一氧化碳,用如下的装置进行实验。请回答:
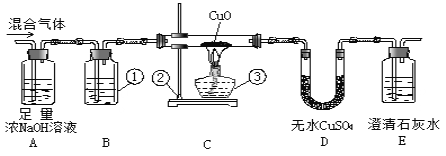
(1)写出标有番号的仪器名称:①___________,②_____________,③_____________。
(2)装置B中用的试剂是 _______________,目的是为了_______________________。
(3)当观察到E装置中出现____________现象时,说明混合气体中一定含有一氧化碳。
(4)如果混合气体中含有一氧化碳,为了保护环境,应在E装置右边的排气管口采取的措施是_____。
(5)A装置的作用是___________,反应的化学方程式是___________________。
(6)假设混合气体中的CO与CuO完全反应,当通入的气体为mg, D增重ng,E瓶增重pg。则混合气体中CO的质量百分数为:_________%;如果去掉D装置,这里计算的CO的质量百分数准确吗?为什么?___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如图所示。
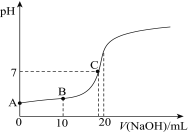
(1)A点溶液pH > 1,用电离方程式解释原因:___________________。
(2)下列有关B点溶液的说法正确的是_______(填字母序号)。
a.溶质为:CH3COOH、CH3COONa
b.微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c.微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d.微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(3)C点溶液中离子浓度的大小顺序:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。回答下列问题(相关数据如下):
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
ⅡA元素氢氧化物 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | ||||
25℃时饱和溶液浓度molL-1 | 8.00×10-6 | 5.00×10-4 | 2.00×10-2 | 6.00×10-2 | 2.00×10-1 | ||||
I.(1)SrO2中氧元素的化合价为___。Sr(OH)2的碱性比Mg(
(2)工业上可以用SrO与铝粉充分混合,在真空加热反应生成金属锶和3SrO8Al2O3,写出该反应的化学方程式___。
Ⅱ.以天青石(主要含有SrSO4和少量CaCO3杂质)生产Sr(OH)2xH2O的工艺如下:
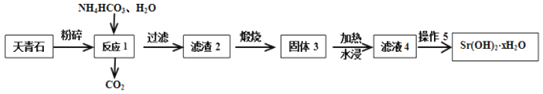
(3)滤渣2为混有CaCO3的SrCO3,写出生成SrCO3的化学方程式___。
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2涪液,此时应缓慢加热使沉淀颗粒长大,有利于___。
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤、洗涤、干燥。为得到较大颗粒的Sr(OH)2xH2O晶体,可采用的方法是___(填一种)。
(6)取m g纯净Sr(OH)2xH2O产品溶于水,加入过量纯碱溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=___(用含m、n的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com