
【题目】50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
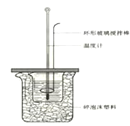
(1)环形玻璃搅拌棒_____(填能或不能)改为环形金属棒。其原因是________。
(2)大烧杯内填满碎泡沫塑料的作用______。
(3)实验中将氢氧化钠溶液分多次加入盐酸中,对求得中和热数值的影响是________(偏高或偏低或无影响)。
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放出的热量_______(增加、减少或不变),所求中和热数值____(增加、 减少或 不变)。
【答案】不能 因金属易导热 减少实验过程中的热量损失 偏低 增加 不变
【解析】
(1)环形金属棒是热的良导体,会使热量损失;
(2)中和热测定实验成败的关键是保温工作;
(3)分多次把NaOH溶液倒入盛有HCl的烧杯中,热量损失较大;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答。
(1)金属容易导热使热量损失,导致中和热测定不准确,因此不能使用金属棒;
(2)中和热测定实验成败的关键是保温工作,根据量热计的构造和实验的成败关键来判断该装置的大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失;
(3)尽量一次快速将NaOH溶液倒入盛有盐酸的烧杯中,不允许分多次把NaOH溶液倒入盛有盐酸的小烧杯中,否则会导致热量损失较多,影响中和热的测定,导致中和热数值偏低;
(4)反应放出的热量和所用酸以及碱的量的多少有关,若改用60mL 1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,反应生成水的物质的量增多,所放出的热量增加,但是由于中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以中和热不变。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表示中正确的是( )
A. 乙醇分子的球棍模型为 B. 一氯甲烷的电子式为
B. 一氯甲烷的电子式为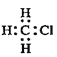
C. 乙酸的结构简式:C2H4O2D. 分子组成为C5H12的有机物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应;熔点为-80℃,沸点137.l℃。在熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。

请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2:b→___;
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
A、x+y<n B、该化学平衡向右移动
C、B的转化率增大 D、C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中逐滴滴加2mol/L NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如下图所示。则:

(1)写出代表各线段发生反应的离子方程式:OA段____________,AB段___________,图中线段OP∶PB=___________。
(2)计算原AlCl3溶液的物质的量浓度为_________。
(3)图中A对应的横坐标为______mL。
(4)当加入12mL NaOH溶液时,产生沉淀量为______mol。
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式C(s)+H2O(g) ![]() CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
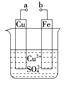
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
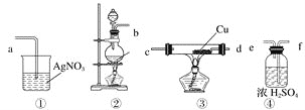
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com