
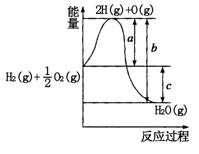
| A.在相同的条件下,红磷比白磷稳定 |
| B.在相同的条件下,白磷比红磷稳定 |
| C.红磷和白磷的结构相同 |
| D.红磷容易发生自燃而白磷则不会自燃 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 结论 |
| A | Na2S2O3溶液与稀H2SO4溶液混合时,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参加化学反应 |
| C | 将NH4Cl晶体与Ba(OH)2.8H2O晶体混合后研磨,烧杯壁温度降低 | 该反应为吸热反应 |
| D | 在容积可变的密闭容器中发生反应 H2(g)+ I2(g)  2HI(g), 2HI(g),把容积缩小一倍 | 正反应速率加快,逆反应速率不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)
CH3OH(g)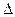 H1
H1 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)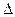 H2
H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
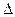 H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”); .2mol·L-1,则CO的转化率为 ,此时的温度
.2mol·L-1,则CO的转化率为 ,此时的温度 CH4(g)+3/2O2(g)
CH4(g)+3/2O2(g) CO(g)+2H2O(g)
CO(g)+2H2O(g)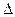 H=-519kJ·mo
H=-519kJ·mo l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)
l-1。工业上,为选择合适的催化剂,分别对X、Y、Z三种催化剂进行了如下实验(其他条件相同)  T1℃时催化效率最高,能使正反应速率加快约3×105倍;
T1℃时催化效率最高,能使正反应速率加快约3×105倍;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1 CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1 CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1| A.加入某物质作催化剂 | B.加入一定量CO |
| C.反应温度降低 | D.增大容器体积 |
 CH3OCH3(g)+CO2(g)的△H= ;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H= ;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。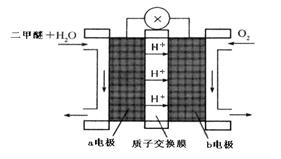
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.伴有能量变化的物质变化都是化学变化 |
| B.物质发生化学变化都伴随着能量变化 |
| C.化学反应中,反应物的总能量低于生成物的总能量 |
| D.化学反应中,反应物的总能量高于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com