
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | |
| 2 | 0.1mol | 0.3mol | 0.1mol |
| A. | 只有K+的物质的量相等 | B. | 只有Cl-的物质的量相等 | ||
| C. | 完全相同 | D. | 各离子的物质的量完全不同 |
分析 题中涉及物质都为强电解质,在溶液中完全电离,根据各电解质的物质的量计算离子的物质的量,确定离子关系,以此解答该题.
解答 解:①中n(K+)=0.3mol+0.2mol×2=0.7mol,n(SO42-)=0.2 mol+0.1mol=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.3 mol,
②中n(K+)=0.1mol+0.3mol×2=0.7mol,n(SO42- )=0.3mol,n (Zn2+)=0.1 mol,(Cl-)=0.1mol+0.1mol×2=0.3 mol,
所以①和②中各种离子的物质的量:n(K+)=0.7 mol,n(SO42-)=0.3 mol,n (Zn2+)=0.1 mol,n(Cl-)=0.3 mol,所以成分相同,
故选C.
点评 本题综合考查物质的量,为高频考点,侧重学生的分析能力和计算能力的考查,注意物质的构成特点,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中滴加足量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 铜片与浓HNO3:Cu+2NO3-+2H+=Cu2++2NO2↑+H2O | |
| C. | NH4HCO3溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 一水合氨的电离:NH3•H2O=NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+$\frac{1}{2}$c(SO32-) | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| D. | 加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
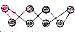 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①④⑤ | C. | ①②③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以石墨为电极,电解含甲基橙的0.1 mol/L硫酸溶液 | |
| B. | 以铜为电极,电解1 mol/L硫酸溶液 | |
| C. | 以石墨为电极,电解含酚酞的饱和食盐水 | |
| D. | 以石墨为电极,电解1 mol/L溴化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 最外层电子数 | 次外层电子数 |
| D | x | x+4 |
| E | x+1 | x+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥、玻璃、陶瓷等硅酸盐材料都不溶于水,所以所有的硅酸盐都不溶于水 | |
| B. | 水泥的主要成分有硅酸三钙(3CaO•SiO2)、硅酸二钙(2CaO•SiO2)及其他一些成分,所以硅酸盐都是氧化物 | |
| C. | 陶瓷分为土器、陶器、瓷器、炻器,与原料粘土的纯度有关 | |
| D. | 普通玻璃是透明的,所以硅酸盐也是透明的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com