
���� �����Լ�1�ܽ�ҩƷ����������������ܽ⣬�������������ױ��������ʼ������軯�ر�dz��ɫ���μ�������ˮ�����������������������ӣ������������軯�ر��ɫ������ɫ���Vc���л�ԭ�ԣ��ɰ������ӻ�ԭΪ�������ӣ��ʺ�ɫ��ȥ��
��1������������ˮ���������ӱ�����Ϊ�����ӣ�
��2��Fe2+������Ѫ�쵰�����������������ã�Fe3+û�д˹��ܣ�VcƬ���л�ԭ�ԣ��ܹ���ԭ�������������ɶ��������ӣ�
������ؾ���ǿ�����ԣ��ɰ����������������ữʱ�����û�ԭ���ᣬ��ֹ���������������ͨ���ζ��ɼ����������ӵĺ�����
��3���Լ�1���ܽ����ã����ᡢϡ������ɣ����Լ�2���������ᣬ�ױ��������������Ӱ��ʵ��ⶨ��
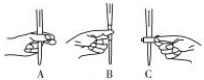
��4��KMnO4��Һ����ʽ�ζ���ʢ�ţ��ζ�ʱ��ת������
��5������5Fe2++8H++MnO4-�T5Fe3++Mn2++4H2O���㣮
��� �⣺��1������������ˮ���������ӱ�����Ϊ�����ӣ����ӷ�ӦΪ2Fe2++Cl2=2Cl-+2Fe3+���ʴ�Ϊ��2Fe2++Cl2=2Cl-+2Fe3+��
��2�����������ױ�������������ҩ����������������������VcƬ���л�ԭ�ԣ��ܹ���ԭ�������������ɶ��������ӣ�Fe2+������Ѫ�쵰��������O2�����ã�Fe3+û�д˹��ܣ�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+�������ֻ������Fe2+��Fe2+������Ѫ�쵰��������O2 �����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+��
�ʴ�Ϊ��Fe2+������Ѫ�쵰��������O2 �����ã�Fe3+û�д˹��ܣ�����Vc���ɷ�ֹҩƷ�е�Fe2+��������Fe3+�������ֻ������Fe2+��Fe2+������Ѫ�쵰��������O2 �����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+��
��3���Լ�1���ܽ����ã����ᡢϡ������ɣ����Լ�2���������ᣬ�ױ��������������Ӱ��ʵ��ⶨ�����ʵ���е��Լ�2���ͬѧ��Ƶ�ʵ���е��Լ�1��������ϡ���ᣬ�ʴ�Ϊ��C��
��4��KMnO4��Һ����ʽ�ζ���ʢ�ţ��ζ�ʱ������ת������ֻ��ͼA���ϣ��ʴ�Ϊ��A��
��5���躬��������Ϊxmol����
5Fe2++8H++MnO4-�T5Fe3++Mn2++4H2O
5 1
x 0.02mol��12��0.001L��
x=1.2��10-3mol��
1000mL��Һ��ȡ��20.00mL����ҩƷ�к�n��Fe2+��=0.0200mol/L��12.00��10-3L��5��$\frac{1000ml}{20ml}$=0.0600mol��
m��Fe2+��=0.0600mol��56g/mol=3.36g��
������������$\frac{3.36g}{10g}$��100%=33.6%��
�ʴ�Ϊ��33.6%��
���� ���⿼�����ʵĺ�����̽��ʵ�飬Ϊ��Ƶ���㣬���շ����Ļ�ѧ��Ӧ��ʵ�����Ϊ���Ĺؼ������ط������������������Ŀ��飬ע����Ϣ����ѧ֪ʶ�Ľ�ϣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����һ�ֹ�ҵ�Ʒ�
����һ�ֹ�ҵ�Ʒ� ��Ũ����Zn-HgR1-CH2-R2������R1��R2��ʾ��������ԭ�ӣ�
��Ũ����Zn-HgR1-CH2-R2������R1��R2��ʾ��������ԭ�ӣ� +RCOOH
+RCOOH
 ��G
��G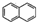 ��H
��H ��
�� ��
�� ������һ�֣���
������һ�֣����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
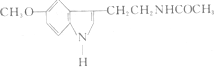
| A�� | �����ڷ����� | B�� | �����ڸ߷��ӻ����� | ||
| C�� | ����ʽΪC13 H15N2O2 | D�� | ��һ�������¿��Է����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
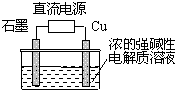 Cu2O��һ�ְ뵼����ϣ���ȡCu2O�ĵ�����ͼ���ܷ�ӦΪ��2Cu+H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cu2O+H2��������˵������ȷ���ǣ�������
Cu2O��һ�ְ뵼����ϣ���ȡCu2O�ĵ�����ͼ���ܷ�ӦΪ��2Cu+H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cu2O+H2��������˵������ȷ���ǣ�������| A�� | ͭ�缫����������Ӧ | |
| B�� | ͭ�缫��ֱ����Դ�ĸ��� | |
| C�� | ʯī�缫�ϲ������� | |
| D�� | ÿ����1molCu2Oʱ������2mol����ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
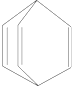
| A�� | Ͱϩ��һ���������ܷ����Ӿ۷�Ӧ | |
| B�� | Ͱϩ�뱽��ϩ��C6H5CH�TCH2����Ϊͬ���칹�� | |
| C�� | Ͱϩ�е�һ����ԭ�ӱ���ԭ��ȡ�������ò���ֻ������ | |
| D�� | Ͱϩ���������е�ԭ����ͬһƽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4 | B�� | NH4+ | C�� | NH2- | D�� | Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2������һ������SO3������ | |
| B�� | ��÷�ӦΪ���ȷ�Ӧ���ʲ��ؼ��ȾͿɷ��� | |
| C�� | O2������һ������SO2������ | |
| D�� | SO2��O2��������һ������SO3�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��C��s��ʯī����C��s�����ʯ��-1.9 kJ����֪��ʯī�Ƚ��ʯ���ȶ� | |
| B�� | ���������������������ֱ���ȫȼ�գ����߷ų����������� | |
| C�� | ��H+��aq��+OH-��aq����H2O��l��+57.3 kJ����֪����1 mol CH3COOH����Һ�뺬1 mol NaOH����Һ��ϣ��ų���������57.3 kJ | |
| D�� | 2 g H2��ȫȼ������Һ̬ˮ�ų�285.8 kJ������������ȼ�յ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g����2H2O��l��+285.8 kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com