
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
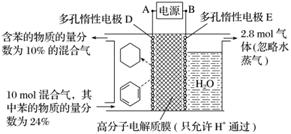
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
答案 ①A→D ②C6H6+6H++6e-===C6H12
③64.3%
解析 由图可知,苯转化为环己烷的过程是加氢过程,发生还原反应,故为阴极反应,所以A为电源的负极,B为电源的正极。
①电子从负极流向阴极,即A→D。
②该装置的目标是从苯到环己烷实现储氢,电极反应式为C6H6+6H++6e-===C6H12。
③阳极反应式为2H2O-4e-===O2↑+4H+,生成2.8 mol氧气,失去11.2 mol电子。电解过程中通过阴、阳极的电子数目相等,即阴极得到电子也为11.2 mol。阴极除生成环己烷外,还生成H2:2H++2e-===H2↑,由题意可知,2n(H2)+6n(C6H12)=11.2 mol,[10 mol+n(H2)]×10%=10 mol×24%-n(C6H12);解得n(H2)=2 mol,n(C6H12)=1.2 mol,故生成1.2 mol C6H12时转移电子1.2 mol×6=7.2 mol,电流效率η=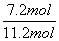 ×100%≈64.3%。
×100%≈64.3%。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
明矾石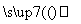


请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为__________________________。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式:______________。
(4)请你写出验证溶液1中有NH 的实验过程:________________________。
的实验过程:________________________。
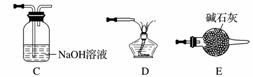
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②检查装置A气密性的方法是________________________________________________________________________。
③在点燃B处的酒精灯前,应进行的操作是__________________。
④装置C的作用是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式___________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式______________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式____________________________________________________;
阴极反应式____________________________________________________;
总反应离子方程式_______________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式_____________________________________________________;
阴极反应式_____________________________________________________;
总反应化学方程式_______________________________________________。
(4)用铁作电极电解NaOH溶液
阳极反应式______________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式_________________________________________________。
(5)用铜作电极电解盐酸溶液
阳极反应式_________________________________________________________;
阴极反应式_________________________________________________________;
总反应离子方程式__________________________________________________。
(6)用Al作电极电解NaOH溶液
阳极反应式________________________________________________________;
阴极反应式________________________________________________________;
总反应离子方程式__________________________________________________。
(7)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式________________________________________________________;
阴极反应式_______________________________________________________;
总反应离子方程式___________________________________________________。
(8)用Al单质作阳极,石墨作阴极,电解NaHCO3溶液
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
(9)用惰性电极电解熔融MgCl2
阳极反应式__________________________________________________________;
阴极反应式__________________________________________________________;
总反应离子方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
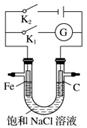
A.K1闭合,铁棒上发生的反应为2H++2e-—→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
现将氯化铝溶液蒸干灼烧并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是( )
A.阴极产物是氢气
B.阳极产物是氧气
C.阴极产物是铝和氧气
D.阳极产物只有氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解100 mL 4 mol·L-1的CuSO4溶液,一定时间后在阳极收集到1.12 L气体,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+浓度为(设溶液的体积不变,反应前后均为标准状况)( )
A.2.7 mol·L-1 B.3 mol·L-1
C.4 mol·L-1 D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是( )
A.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=+890.3 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)2013年以来,全国很多地区都曾陷入严重的雾霾和污染天气中,冬季取暖排放的CO2、汽车尾气等都是形成雾霾的因素。
已知:①N2(g)+O2(g)===2NO(g)
ΔH=+179.5 kJ·mol-1
②2NO(g)+O2(g)===2NO2(g)
ΔH=-112.3 kJ·mol-1
③2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-759.8 kJ·mol-1
下图是在101 kPa,298 K条件下1 mol NO2和1 mol CO反应生成1 mol CO2和1 mol NO过程中能量变化的示意图。则a=________。

(2)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
已知:


①反应Ⅱ是______反应(填“吸热”或“放热”),其原因是
________________________________________________________________________。
②反应A的热化学方程式是____________。
(3)一定条件下,在容积为3 L的密闭容器中反应:CO(g)+2H2(g)??CH3OH(g)达到化学平衡状态。
根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
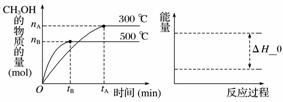
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com