
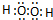 .
.分析 根据题意,A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小,则A、B为金属,A与B质子数之和是D质子数的3倍,则A、B的质子数之和为3的倍数,故A、B处于第三周期,则A为Na元素、B为Al元素;D的质子数为$\frac{11+13}{3}$=8,则D为氧元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据;②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素,以此解答该题.
解答 解:根据题意,A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小,则A、B为金属,A与B质子数之和是D质子数的3倍,则A、B的质子数之和为3的倍数,故A、B处于第三周期,则A为Na元素、B为Al元素;D的质子数为$\frac{11+13}{3}$=8,则D为氧元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为硫元素,m=2;根据;②Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素,
(1)HmDm为H2O2,电子式为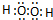 ,故答案为:
,故答案为: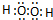 ;
;
(2)由于非金属性Cl>S,单质的氧化性Cl2>S,单质的氧化性越强,对应阴离子的还原性越弱,则有还原性:S2->Cl-,可通过反应Cl2+S2-=2Cl-+S↓证明,故答案为:Cl2+S2-=2Cl-+S↓;
(3)E的单质为氯气,A与D形成的化合物的水溶液为NaOH溶液,在常温下氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,常温下,将等物质的量浓度的H2S溶液和NaOH溶液等体积混合,该反应的离子方程式为H2S+OH-=HS-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;H2S+OH-=HS-+H2O;
(4)将等物质的量浓度的H2S溶液和NaOH溶液等体积混合,所得溶液中溶质为硫氢化钠,含有离子键、共价键,
故答案为:离子键、共价键;
(5)从转化关系可以看出,单质所含元素为变价元素,含有多种化合价,能和氧气反应生成两种氧化物,以上元素中有Na、S元素符合,
故答案为:Na、S.
点评 本题考查位置结构性质的关系及应用、常用化学用语、元素化合物性质等,题目难度较大,正确推断元素的种类为解答该题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Cu2+ | C. | Al3+ | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有第ⅠA族的元素所形成的单质在O2中燃烧时均可生成R2O(R代表碱金属元素) | |
| B. | 根据Mg(OH)2、Ca(OH)2、Ba(OH)2的溶解性,可推出Sr(OH)2可能在水中有较大的溶解度 | |
| C. | 第ⅥA族元素形成的化合物种类最多 | |
| D. | 若用NA表示阿伏伽德罗常数,则4.4g CO2中含有电子的数目为0.8NA个e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚溶液、乙烷、乙烯、乙醇、溴苯4种物质可用溴水一次鉴别 | |
| B. | CH3CH2OH、CH2=CHCOOH、CH3CHO、CH3COOH四种溶液可用新制Cu(OH)2一次鉴别 | |
| C. | 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 | |
| D. | KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 操作 |
| A | 验证Cl2和Br2的非金属性强弱 | 将少量氯水加入盛有FeBr2溶液的试管中,用力振荡后加入少量乙醇,振荡,静置 |
| B | 检验溶液中是否含有SO42- | 用HNO3溶液酸化后再加BaCl2溶液 |
| C | 证明浓硫酸有脱水性和强氧化性 | 将浓硫酸滴到蔗糖表面 |
| D | 制取Fe(OH)3胶体 | 将烧碱溶液滴加到FeCl2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液(NaCl):渗析 | |
| B. | 乙醇(乙酸):加NaOH溶液,分液 | |
| C. | 乙醛溶液(乙酸):加NaOH溶液,蒸馏 | |
| D. | 肥皂液(甘油):加食盐搅拌、盐析、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其系统命名为2-甲基-1-丙烯.
,其系统命名为2-甲基-1-丙烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
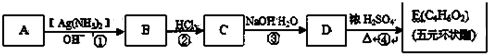
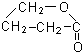 +2H2O.
+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com