
分析 根据n=$\frac{m}{M}$计算出金属锌的物质的量,然后结合反应方程式计算出200mL盐酸中含有HCl的物质的量,最后根据c=$\frac{n}{V}$计算出该盐酸中溶质的物质的量浓度.
解答 解:13g锌的物质的量为:n(Zn)=$\frac{13g}{65g/mol}$=0.2mol,
Zn+2HCl=H2↑+ZnCl2
1 2
0.2mol n(HCl)
n(HCl)=$\frac{0.2mol×2}{1}$=0.4mol
该盐酸的物质的量浓度为:c(HCl)=$\frac{0.4mol}{0.2L}$=2 mol/L,
答:该盐酸的物质的量浓度为2 mol/L.
点评 本题考查了化学方程式的计算、物质的量浓度的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握物质的理念的概念及表达式,试题有利于提高学生的灵活应用能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 含D的盐溶液一定显酸性 | |
| B. | 可电解熔融DE3冶炼D单质 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 1 mol 由元素A、B组成的化合物可能含有18 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
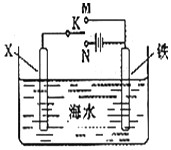 利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.
利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于N(填M或者N)处,此时溶液中的阴离子向X极(填X或铁)移动.若X为锌,开光K置于M处,该电化学防护法称为:牺牲阳极的阴极保护法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.5NA个氯气分子所占体积约是11.2 L | |
| B. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| C. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2摩/升 | B. | 0.4摩/升 | C. | 0.8摩/升 | D. | 1.6摩/升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的KNO3 溶液500 ml | B. | 0.05mol/L的K2SO4 溶液300ml | ||
| C. | 0.04mol/L的K3PO4 溶液100 ml | D. | 0.06mol/L的KHCO3 溶液120 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.16mol | B. | 0.21mol | C. | 0.30mol | D. | 0.48mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com