
分析 碱溶液和强碱弱酸盐的溶液显碱性,碱能够电离出氢氧根离子,强碱弱酸盐在溶液中水解生成氢氧根离子显碱性.
解答 解:a.NH3•H2O属于弱碱在溶液中部分电离出氢氧根离子溶液显碱性,其电离方程式为:NH3.H2O=NH4++OH-;
b.NaAlO2 为强碱弱酸盐在溶液中水解生成氢氧根离子显碱性,其水解方程式为:AlO2-+2H2O=Al(OH)3+OH-;
c.NH4Cl属于强酸弱碱盐,在溶液中水解显酸性;
d.NaHSO4在溶液中完全电离出氢离子和钠离子,溶液显酸性;
故答案为:a、b;NH3.H2O=NH4++OH-、AlO2-+2H2O=Al(OH)3+OH-.
点评 本题考查了弱电解质的电离和盐的水解,题目难度不大,侧重于基础知识的考查,注意把握水解原理和规律.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据甲烷分子中四个键的键角相等,就可推知甲烷为正四面体结构 | |
| B. | 分子式为C4H8的烯烃与氢气加成反应后得到的烷烃有3种 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 苯中无碳碳双键,化学性质稳定,不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形.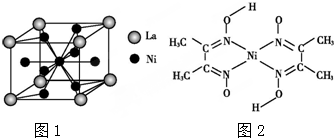
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的饱和溶液中Na+、NH4+、C6H5O-、SO42- | |
| B. | 甲基橙变红的溶液中液中K+、Ca2+、AlO2-、NO3- | |
| C. | 0.1mol•L-1NH4Cl溶液中K+、Na+、HCO3-、SO42- | |
| D. | 与Al反应生成H2的溶液中Na+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c (Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 等物质的量浓度的NH4HSO4、NH4HCO3溶液中c(NH4+)大小:NH4HSO4>NH4HCO3 | |
| C. | 0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,则BA(盐)溶液pH<7 | |
| D. | 4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以减少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 陈述I | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | I对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁的某些化合物可用作催化剂 | I错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | I对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体物质加压或降温时能凝结或凝固 | |
| B. | 碘溶于四氯化碳 | |
| C. | 氟、氯、溴、碘单质的熔沸点依次升高 | |
| D. | 食盐熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com