
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
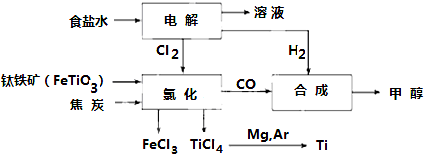
分析 (1)Fe的原子序数为26,根据核外电子排布式确定在周期表中的位置;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO;
(3)TiCl4水解生成TiO2•xH2O,同时生成HCl;
(4)真空蒸馏的方法分离得到Ti,由表格中数据可知,1412℃Mg、MgCl2为气态,而Ti没有熔化;
(5)电解饱和食盐水,依据电极反应判断生成产物,书写离子方程式.
解答 解:(1)Fe的原子序数为26,其最外层电子数为2,有4个电子层,原子核外电子排布为1s22s22p63s23p63d64s2,故处于第四周期第VIII族,
故答案为:第四周期第VIII族;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO,该反应为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)TiCl4水解生成TiO2•xH2O,同时生成HCl,水解方程式为:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl,
故答案为:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl;
(4)真空蒸馏的方法分离得到Ti,由表格中数据可知,1412℃Mg、MgCl2为气态,而Ti没有熔化,则选择温度略高于1412℃即可蒸馏分离,
故答案为:1412;
(5)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
点评 本题以物质的分离提纯流程考查化学反应、物质的分离方法及原子结构等,侧重学生分析能力及知识迁移应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
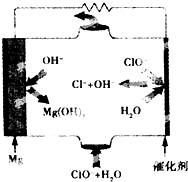 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 池总反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| B. | 正极反应式为ClO-+H2O+2e-=Cl-+2OH- | |
| C. | 该燃料电池中镁为负极,发生还原反应电 | |
| D. | 放电过程中OH-移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| B. | CO2、CH4、N2等均是造成温室效应的气体 | |
| C. | 节能减排符合低碳经济的要求 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ③>①>④>② | C. | ①>③>④>② | D. | ②>③>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| B. | 1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| C. | 常温常压下,32 g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C是中学化学的常见物质,它们在一定条件下有如图转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如图转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片跟稀硝酸的反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com