
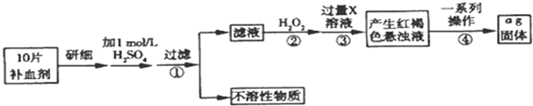
分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)步骤①操作为过滤,需要用到的主要玻璃仪器有漏斗、烧杯、玻璃棒;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答 解:(1)步骤①操作为过滤,需要用到的主要玻璃仪器有漏斗、烧杯、玻璃棒;故答案为:漏斗、烧杯、玻璃棒;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,
故答案为:氧化;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;洗涤;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量$\frac{ag×\frac{112}{160}}{10}$×100%=0.07ag,则每片补血剂含铁元素的质量分数为$\frac{0.07ag}{bg}$×100%=$\frac{7a}{b}$%,故答案为:$\frac{7a}{b}$%.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有10NA个质子 | |
| B. | 7.8 g Na2O2中含有的阴离子数是0.2NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 1 | 543 | 催化剂 A | 12.3 | 42.3 |
| 2 | 543 | 催化剂B | 10.9 | 72.7 |
| 3 | 553 | 催化剂 A | 15.3 | 39.1 |
| 4 | 553 | 催化剂B | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟利昂或NO2都可破坏臭氧层而导致“温室效应” | |
| B. | 蜂蚁蜇咬人的皮肤时,会将分泌物甲酸注入人体,使人感到疼痛难忍,涂抹稀氨水或者碳酸氢钠溶液可以减轻疼痛 | |
| C. | 向燃料煤中加入生石灰,可减少对大气的污染 | |
| D. | 热水瓶中的水垢的主要成分是CaCO3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.57 mol | B. | 2.25mol | C. | 2 mol | D. | 0.63mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:4 | C. | 1:6 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com