

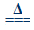 2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑ (Ⅱ)2AgNO3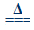 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。

科目:高中化学 来源:不详 题型:单选题
| A.第三周期 | B.第二周期 |
| C.第Ⅳ主族 | D.第Ⅴ主族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.5a mol | B.2a mol | C.0.1a mol | D.(0.1+a)mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.高聚氮与氮气互为同位素 |
| B.14g高聚氮含3.01×1023个氮原子 |
| C.高聚氮中氮原子间的化学键为非极性键 |
| D.高聚氮转变成氮气是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 |
| C.铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.HNO3→NO→NO2,以上各步变化均能通过一步实现 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
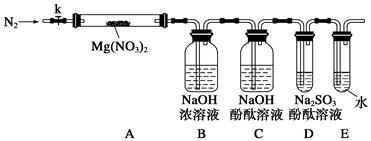
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com