
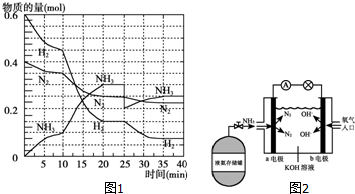
 氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:分析 (1)10min内氨气的物质的量不会为0.10mol,根据反应速率v=$\frac{\frac{△n}{V}}{△t}$计算;
(2)根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
(3)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(4)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;相同条件下气体体积分数等于其物质的量分数;
(5)25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,据此判断改变的条件;
(6)已知:①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
根据盖斯定律②×3-①×2可得4NH3(g)+3O2(g)═2N2(g)+6H2O(g),据此计算出其焓变即可;
(7)①燃料电池中,负极上是燃料氨发生失电子的氧化反应;
②根据电极反应式分析氢氧根离子浓度的变化情况.
解答 解:(1)根据图象可知,10min时氨气的物质的量为0.1mol,则10min内用NH3表示该反应的平均速率为:v(NH3)=$\frac{\frac{0.10mol}{2L}}{10min}$=0.005 mol/(L•min),
故答案为:0.005 mol/(L•min);
(2)由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.025mol×4=0.1mol,△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂;而降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故只有使用催化剂符合,故a正确,
故答案为:a;
(3)a.3v(H2)正=2v(NH3)逆,表示的是正反应和逆反应,但是不满足计量数关系,说明没有达到平衡状态,故a错误;
b.混合气体的质量不变,气体的体积不变,故密度不变,若密度不再随时间变化,不能说明平衡,故b错误;
c.容器内前后气体的物质的量有变化,说明压强时变量,总压强不再随时间而变化,说明平衡,故c正确;
d.N2、H2、NH3的分子数之比为1:3:2,无法判断各组分的浓度是否不再变化,故d错误;
e.单位时间生成m mol N2的同时消耗3m mol H2,方向相反成正比例,故e正确;
f.a mol N≡N键断裂的同时,有6a mol N-H键合成,表示的都是正反应,无法判断是否达到平衡状态,故f错误;
故答案为:c e;
(4)由图象可知,20min时该反应第一次达到平衡状态,n(N2)=0.025mol×10=0.25mol,则c(N2)=$\frac{0.25mol}{2L}$=0.125mol/L,n(H2)=0.025mol×6=0.15mol,则c(H2)=$\frac{0.15mol}{2L}$=0.075mol/L,n(NH3)=0.025mol×12=0.3mol,则c(NH3)=$\frac{0.3mol}{2L}$=0.15mol/L,所以第一次平衡时,平衡常数K1=$\frac{(0.15)^{2}}{(0.125)×(0.075)^{3}}$;此时氨气的体积分数=物质的量分数=$\frac{0.3mol}{0.25mol+0.15mol+0.3mol}$×100%≈42.86%,
故答案为:K1=$\frac{(0.15)^{2}}{(0.125)×(0.075)^{3}}$;42.86%;
(5)根据图象可知第25分钟时NH3的物质的量突然减少,H2、N2的物质的量不变,说明改变条件应是移走了生成的NH3,
故答案为:移走了生成的NH3(或减小了氨气的浓度);
(6)已知:①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
根据盖斯定律②×3-①×2得:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=(-483.6kJ/mol)×3-(-92.4kJ/mol)×2=-1266kJ/mol,
即氨气完全燃烧生成气态水的热化学方程式是:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266kJ/mol,
故答案为:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266kJ/mol;
(7)①燃料电池中,负极上是燃料氨发生失电子的氧化反应,a电极通入的是氨气,为负极,负极上燃料氨气失电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-═N2+6H2O,b电极为正极,电极反应为:O2+2H2O+4e-=4OH-,
故答案为:2NH3-6e-+6OH-═N2+6H2O;
②反应一段时间后,由于电池反应生成水,4NH3+3O2=2N2+6H2O,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,为维持碱溶液的浓度不变需要向装置中补充KOH,
故答案为:由于电池反应生成水,4NH3+3O2=2N2+6H2O,所以电解质中氢氧根浓度减小,即碱性减弱,pH减小,为维持碱溶液的浓度不变需要向装置中补充KOH.
点评 本题考查较为综合,涉及化学平衡计算、反应热与焓变、原电池工作原理、化学平衡状态的判断等知识,题目浓度较大,明确化学平衡及其影响为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
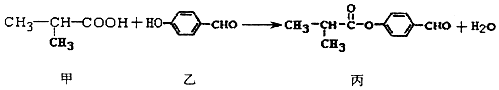
| A. | 丙的分子式为C11H11O3 | |
| B. | 甲分子中含有1个手性碳原子 | |
| C. | 乙、丙各lmol分别和氢气反应,最多消耗氢气均为4mol | |
| D. | 丙可发生加成反应、取代反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验装置 | 实验现象 |
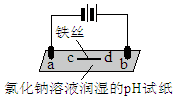 | a处试纸变蓝; b处变红,局部褪色; c处试纸变蓝; d处无明显变化 |
| A. | a为电解池的阴极 | |
| B. | b处有氯气生成,且与水反应生成了盐酸和次氯酸 | |
| C. | d处发生了反应:Fe-3e-=Fe3+ | |
| D. | c处:2H2O+2e-=H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用蒸馏水 | B. | 使用NaHCO3溶液 | ||
| C. | 使用CuSO4和NaOH溶液 | D. | 使用pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
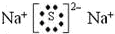 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化是,c(I-):c(Br-)═1:1 | |
| D. | 当a=0.28时,4Fe2++10I-+7Br2═4Fe3++5I2+14Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
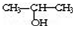 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2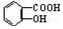 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备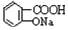
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com