
| A. | HClO+SO2+H2O═HCl+H2SO4:酸性 HClO>H2SO4 | |
| B. | Al2O3+2NaOH═2NaAlO2+H2O:Al2O3是两性氧化物 | |
| C. | NH3+H3O+═NH4++H2O:NH3结合H+的能力比H2O强 | |
| D. | 已知C(s,石墨)═C(s,金刚石)△H=+1.9 kJ/mol:金刚石比石墨稳定 |
分析 A.发生氧化还原反应不能比较酸性;
B.与酸、碱均反应生成盐和水,可判断两性;
C.由反应可知氨气结合氢离子;
D.△H>0,反应为吸热反应,则石墨的能量低.
解答 解:A.发生氧化还原反应不能比较酸性,应利用强酸制取弱酸的反应比较酸性,硫酸为强酸、HClO为弱酸,故A错误;
B.与酸、碱均反应生成盐和水,可判断两性,则由Al2O3+2NaOH═2NaAlO2+H2O可知为酸性氧化物的性质,故B错误;
C.由反应可知氨气结合氢离子,NH3结合H+的能力比H2O强,故C正确;
D.△H>0,反应为吸热反应,则石墨的能量低,则石墨稳定,故D错误;
故选C.
点评 本题考查物质的性质,为高频考点,把握物质的性质、相关反应原理为解答的关键,侧重分析与应用能力的考查,注意反应原理的综合应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 间二甲苯只有一种 | B. | 对二甲苯只有一种 | ||
| C. | 邻二甲苯只有一种 | D. | 苯能与液溴反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Mn2O7、Fe2O3均为碱性氧化物 | |
| B. | 烧碱不是碱、石炭酸不是酸、双氧水不是水 | |
| C. | 电解质在水溶液中的反应都是离子反应 | |
| D. | 单质都有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA | |
| B. | 1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个 | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间的延长而变化 | |
| B. | 单位时间内每消耗m个A分子的同时也生成了d个D分子 | |
| C. | 单位时间内每生成e个C分子的同时也生成了n个B分子 | |
| D. | A、B、C、D四种物质的分子数之比为m:n:e:d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
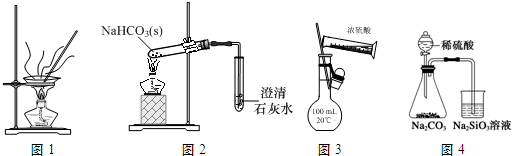
| A. | 用图1装置灼烧CuSO4•5H2O晶体除去结晶水 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置配制100 mL 0.1 mol•L-1的硫酸 | |
| D. | 用图4装置比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com