
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
(1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的表现
C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,比较二者的活动性
D.分别做铝片、铜片与NaOH溶液反应的实验
E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向
上述方案中能达到实验目的的是_________________。
(2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是________ (填字母代号),作负极的物质发生了________反应(填“氧化”或“还原”)。
(3)将纯锌片和纯铜片按如图所示方式插入100mL相同浓度的稀硫酸一段时间,回答下列问题:

①下列说法正确的是________ (填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的酸性均减弱
②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。
③当甲中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________。
【答案】BCE B 氧化 BD > 甲池锌铜可形成原电池,能加快Zn与硫酸的反应速率 1 mol/L
【解析】
(1)比较金属性强弱,可以根据金属与酸反应的剧烈程度、构成原电池的负极等方面分析,而与硬度、熔沸点等无关,据此进行解答;
(2)自发的氧化还原反应才能设计成原电池;
(3)①甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②形成原电池加快反应速率;
③先计算氢离子的物质的量再计算原来稀硫酸的浓度。
(1)A.铝和铜的硬度和熔点与金属性强弱无关,A错误;
B.金属性越强,与酸反应越剧烈,可通过比较Cu、Al在稀硫酸中的表现判断其金属性强弱,B正确;
C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,根据是否发生置换反应可比较二者的活动性,C正确;
D.Al与氢氧化钠溶液反应是铝的化学特性,与金属活泼性无关,不能根据是否与氢氧化钠溶液反应判断金属性强弱,D错误;
E.将铝片、铜片用导线连接后共同浸入稀盐酸中,接入电流计,观察电流方向,铝为原电池负极,铜为正极,产生电流,据此判断金属性强弱,E正确;
故合理选项是BCE;
(2)反应A.NaOH+HCl=NaCl+H2O不是氧化还原反应,不能设计成原电池,反应B.Zn+H2SO4=ZnSO4+H2↑是氧化还原反应,能设计成原电池,原电池中锌作负极,失电子,发生氧化反应;
(3)①甲装置是原电池,乙装置不构成原电池。
A.甲是化学能转变为电能的装置,乙不是,A错误;
B.乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,B正确;
C.甲、乙中锌片质量都减少,铜片质量都不变,C错误;
D.两个烧杯中都产生氢气,氢离子浓度都降低,因此溶液的pH均增大,D正确;
故合理选项是BD;
②甲构成了原电池,乙没有构成原电池,所以两烧杯中产生气泡的速度:甲>乙;
③释后氢离子的物质的量n(H+)=1L×0.1mol/L=0.1mol,生成氢气物质的量为n(H2)=![]() =0.05mol,则原溶液中氢离子的物质的量n(H+)总=0.1mol+0.05mol×2=0.2mol,因此原硫酸溶液中氢离子的浓度c(H+)=
=0.05mol,则原溶液中氢离子的物质的量n(H+)总=0.1mol+0.05mol×2=0.2mol,因此原硫酸溶液中氢离子的浓度c(H+)=![]() =2mol/L,由于H2SO4是二元酸,一个硫酸分子电离产生两个氢离子,所以原溶液中硫酸的浓度c(H2SO4)=
=2mol/L,由于H2SO4是二元酸,一个硫酸分子电离产生两个氢离子,所以原溶液中硫酸的浓度c(H2SO4)=![]() c(H+)=
c(H+)=![]() =1mol/L。
=1mol/L。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为______________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是_________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中![]() __________________(填“增大”、“减小”或“不变”)。
__________________(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= _________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:

①若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是________________;
为测定Na2CO3和NaHCO3混合物中的质量分数,下列方案可行的是_________________
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
②所得溶液中含量最多的三种离子的物质的量浓度的大小关系为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(忽略溶液体积的变化),溶液中部分微粒的物质的量浓度不正确的是 ( )
A. 向0.20 mol/L NH4HCO3中通入CO2: C(NH4+)=C(HCO3-)+2C(CO32-)
B. 向0.15 mol/L NaHSO3中通入NH3: C(Na+)>C(NH4+)>C(SO32-)
C. 向0.30mol/L Na2SO3中通入CO2: C(Na+)=2[C(SO32-)+C(HSO3-)+C(H2SO3)]
D. 向0.10 mol/L CH3COONa中通入HCl:C(Na+)>C(CH3COOH)=C(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10molL-1氨水的电离度为1.32%,下列有关叙述不正确的是( )
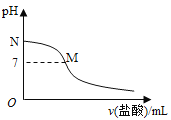
A. 该滴定过程应该选择甲基橙作为指示剂
B. M点对应的盐酸体积大于20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D. N点处的溶液中pH小于12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是( )
A. Zn、Al B. Fe、Zn C. Al、Mg D. Mg、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可以在指定溶液中大量共存的是( )
A.强酸性溶液中:Mg2+、SO42-、Na+B.久置氯水中:K+、CO32-、Ag+
C.无色溶液中:SO42-、MnO4-、Fe3+D.强碱性溶液中:OH-、Cu2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物在酸性催化条件下发生水解反应, 生成两种不同的有机物, 且这两种有机物的相对分子质量相等, 该有机物可能是
A.蔗糖B.麦芽糖C.乙酸乙酯D.甲酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com