
【题目】在一定温度下,10L密闭容器中加入5mol SO2、4mol O2 , 经10min后反应达平衡时有3mol SO2发生了反应.试计算:
(1)用SO2表示该反应的反应速率为多少?
(2)O2的转化率为多少?
(3)平衡常数K为多少?
【答案】
(1)解:利用三段式法计算:
2SO2(g)+ | O2 (g) |
| 2SO3(g) | |
起始: | 5mol | 4mol | 0 | |
转化: | 3mol | 1.5mol | 3mol | |
平衡: | 2mol | 2.5mol | 3mol |
SO2表示该反应的反应速率v(SO2)= ![]() =0.03mol/(Lmin).
=0.03mol/(Lmin).
答:SO2表示该反应的反应速率为0.03mol/(Lmin)
(2)解:O2的转化率为 ![]() ×100%=37.5%.
×100%=37.5%.
答:O2的转化率为37.5%
(3)解:平衡常数K= ![]() =
= 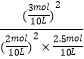 =9mol﹣1L
=9mol﹣1L
故答案为:平衡常数为9mol﹣1L
【解析】根据反应2SO2(g)+O2 (g) ![]() 2SO3(g),利用三段式法计算法,求出反应混合物各组分的物质的量的变化量、平衡时各组分的物质的量.(1)根据v=
2SO3(g),利用三段式法计算法,求出反应混合物各组分的物质的量的变化量、平衡时各组分的物质的量.(1)根据v= ![]() 计算v(SO2).(2)根据转化率的定义计算.(3)化学平衡常数=生成物平衡浓度系数次方之积与反应物平衡浓度系数次方之积的比,平衡常数K=
计算v(SO2).(2)根据转化率的定义计算.(3)化学平衡常数=生成物平衡浓度系数次方之积与反应物平衡浓度系数次方之积的比,平衡常数K= ![]() .
.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】 下列溶液中,Na+的物质的量浓度最大的是( )
A.1 mL 0.5 mol·L-1的NaNO3溶液B.100 mL 0.01 mol·L-1的NaCl溶液
C.100 mL 0.1 mol·L-1的NaOH溶液D.10 mL 0.1 mol·L-1的Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热. 
(1)烧杯间填满泡沫塑料的作用是;
(2)如图所示,仪器A的名称是;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H﹣57.3KJ/mol(填“>”、“<”或“=”);
(3)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硝酸和稀氢氧化钾溶液反应的中和热的热化学方式;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)
(5)为了测量某酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度变化⑦操作所需的时间
A.①②③④
B.①③④⑤
C.③④⑤⑥
D.全部.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学基础:G是一种常见的氨基酸,其合成路线如下 
已知以下信息:
①A苯环上只有1个取代基且核磁共振氢谱有6组峰,其面积比为1:2:2:2:2:1;D和F的苯环上的一氯代物都只有2种.
②F、G能与FeCl3溶液发生显色反应,F能发生银镜反应
③ 
回答下列问题
(1)A的分子式为,其名称为 .
(2)A→B的反应类型是;鉴别A和B可用的试剂是 .
(3)B→C的化学方程式为 .
(4)G的结构简式为 .
(5)F的同分异构构体,含有苯环且能发生水解反应的异构体有种,其中核磁共振氢谱有4组峰,且面积比为3:2:2:1的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学基础:G是一种常见的氨基酸,其合成路线如下 
已知以下信息:
①A苯环上只有1个取代基且核磁共振氢谱有6组峰,其面积比为1:2:2:2:2:1;D和F的苯环上的一氯代物都只有2种.
②F、G能与FeCl3溶液发生显色反应,F能发生银镜反应
③ 
回答下列问题
(1)A的分子式为,其名称为 .
(2)A→B的反应类型是;鉴别A和B可用的试剂是 .
(3)B→C的化学方程式为 .
(4)G的结构简式为 .
(5)F的同分异构构体,含有苯环且能发生水解反应的异构体有种,其中核磁共振氢谱有4组峰,且面积比为3:2:2:1的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分子中既有σ键又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A.①②③
B.③④⑤⑥
C.①③⑥
D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是( )
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得中科院“百人计划”和“863”计划支持的环境友好型铝碘电池是以AlI3溶液为电解质溶液,以金属铝和附有碘单质的石墨为电极形成的原电池.已知电池总反应为2Al+3I2═2AlI3 . 下列说法不正确的是( )
A.电池工作时,溶液中的铝离子向正极移动
B.该电池可能是一种可充电的二次电池
C.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多
D.该电池负极的电极反应为:Al﹣3e﹣═Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com