
【题目】钠,镁,铝,铁四种金属组成的混合物6 g,与足量的稀硫酸反应,产生标准状况下的氢气6.72 L,由此判断混合物中必含 ( )
A.钠B.镁C.铝D.铁
【答案】C
【解析】
标准状况下6.72 L氢气的物质的量=![]() =0.3 mol,故6g混合物提供的电子为0.3 mol×2=0.6 mol,则提供1mol电子需要金属混合物的质量为6g×
=0.3 mol,故6g混合物提供的电子为0.3 mol×2=0.6 mol,则提供1mol电子需要金属混合物的质量为6g×![]() =10g,Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×
=10g,Mg在反应中表现+2价,提供1mol电子需要Mg的质量为24g/mol×![]() =12g,Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×
=12g,Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×![]() =9g,Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×
=9g,Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×![]() =28g,Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g,提供1mol电子,只有Al的质量小于10g,其它金属的质量都大于10g,故金属混合物中一定有Al,故选C。
=28g,Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g,提供1mol电子,只有Al的质量小于10g,其它金属的质量都大于10g,故金属混合物中一定有Al,故选C。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业的原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
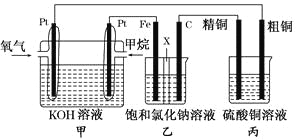
(1)甲烷燃料电池负极反应式为________________________。
(2)石墨(C)极的电极反应式为_______________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体的体积为________L;丙装置中阴极析出铜的质量为________ g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
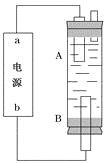
若用于制漂白液,a为电池的________极,电解质溶液最好用)________________
若用于制Fe(OH)2,使用硫酸钠溶液作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确且能合理解释事实的是 ( )
A.由H和Cl形成共价键的过程:![]()
B.用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后,溶液变蓝:4H+ +4I- +O2=2I2 +2H2O
D.向含0.1 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2++4Br-+3C12=2Fe3++2Br2+6C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
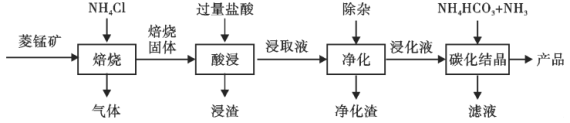
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
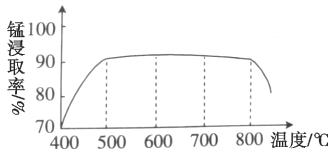
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法或描述正确的是( )
A.硫黄矿制备硫酸经历两步:S![]() SO3
SO3![]() H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.天宫二号空间实验室己于2016年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是___________(填化学式),该物质的类别属于_______(填“碱性氧化物”或“酸性氧化物”),实验室中不能用玻璃塞的试剂瓶盛放KOH溶液,原因是___________________(用离子方程式表示)。
(2)太阳能电池帆板是“天宫二号”空间运行的动力。其性能直接影响到“天宫二号”的运行寿命和可靠性。天宫二号使用的光太阳能电池,该电池的核心材料是_______,其能量转化方式为____________________。
II.铝和氢氧化钾都是重要的工业产品。
请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是____________________。
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____________(填序号)。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,若能,则不用填写理由,若不能,理由是(用离子方程式说明)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A. 氧化物不可能是还原产物,只可能是氧化产物
B. 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C. 饱和溶液一定比不饱和溶液的浓度大
D. 有些化学反应不属于化合、分解、置换、复分解等类型中的任何一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是
A.分子中有N、O、F原子,分子间就存在氢键
B.因为氢键的缘故,![]() 熔沸点高
熔沸点高
C.NH3的稳定性很强,是因为其分子间能形成氢键
D.“可燃冰” 甲烷水合物(8CH4·46H2O)中CH4与H2O之间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.KClO3和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯(ClO2)气体,该反应的化学方程式为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)该反应的还原产物是_____________ (填化学式)。
(2)在反应中浓盐酸表现出来的性质是________(填字母)。
A 只有还原性 B 只有氧化性 C 还原性和酸性 D 氧化性和酸性
(3)若该反应产生2.24L(标准状况)ClO2,则转移电子的物质的量为_____________。
(4)某地生产的氧化钠井盐中含有少量的剧毒物质氰化钠(NaCN),用ClO2可除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒气体。写出该反应的化学方程式: __________。
Ⅱ.(5)一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为_______mol;
(6)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com