
| A. |  用图装置验证化学能转化为电能 | B. |  用图装置量取15.00mL KMnO4溶液 | ||
| C. | 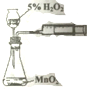 用图装置测定该化学反应速率 | D. | 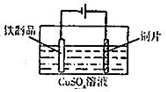 用图装置在铁制品表面镀铜 |
分析 A.没有构成闭合回路;
B.KMnO4溶液有强氧化性;
C.长颈漏斗,不能防止气体逸出;
D.铁制品表面镀铜,Cu作阳极,铁制品作阴极,电解质溶液中含铜离子.
解答 解:A.没有构成闭合回路,不能发生原电池反应,故A错误;
B.KMnO4溶液有强氧化性,应用酸式滴定管盛放,故B错误;
C.定量测定化学反应速率,第二个装置,用长颈漏斗加过氧化氢,虽然过氧化氢在二氧化锰的作用下能生成氧气,但长颈漏斗不能防止生成的氢气从长颈漏斗中逸出,所以右边的针筒中活塞不移动,故不能达到定量测定化学反应速率实验目的,故C错误;
D.铁制品表面镀铜,Cu作阳极,铁制品作阴极,电解质溶液中含铜离子,图中装置符合,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及原电池、中和滴定、化学反应速率、电镀等,注意化学实验操作的考查,熟悉高考中对化学实验注意事项及操作要点的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
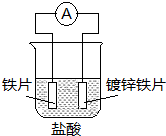
| A. | 溶液中pH值明显下降 | B. | 阴极的电极反应式:Fe-2e→Fe2+ | ||
| C. | 铁片为正极,镀锌铁片为负极 | D. | 电子由锌经溶液流向铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业是电解熔融的NaCl,阳极产生Cl2 | |
| B. | 氢氧燃料电池可将热能直接转化为电能 | |
| C. | 原电池工作时,电子从负极经外电路移向正极 | |
| D. | 工业上电解熔融的AlCl3来制取铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
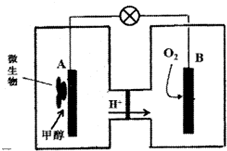 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
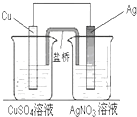 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
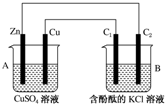 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀铜,表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 铁丝与浓硫酸在常温下钝化 | |
| D. | 在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com