
����Ŀ�����̰��������װ�(OMS-2)��һ�����͵Ļ��������������̿�ͻ�������Ҫ�ɷֱַ�ΪMnO2��FeS2���ϳ�OMS-2�Ĺ����������£�
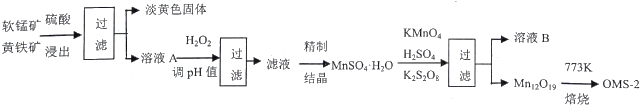
��1��FeS2����Ԫ�صĻ��ϼ���_________������pH�����ˡ���Ҫ��ȥ______Ԫ�ء�
��2��Mn12O19����Ԫ�ػ��ϼ۾�Ϊ-2�ۣ���Ԫ�صĻ��ϼ������֣���Mn (��)��Mn (��) ���ʵ���֮��Ϊ_______________�����������е�ԭ��KMnO4��K2S2O8��MnSO4��H2O�����ʵ�����1:1:5��Ӧ����������Ԫ��ȫ����SO42-����ʽ���ڣ��÷�Ӧ�����ӷ���ʽΪ__________________________��
��3����ҺB�ɽ�һ�������������Ҫ�����һ�ֿ��ڸù�����ѭ��ʹ�ã���ѧʽ��____________����һ��Ϊ���࣬��ũҵ�����п�����___________________________��
��4��OMS-2��һ�������ķ���ɸ���ֱ���OMS-2��MnOx�Լ�ȩ���д�����������ͬʱ���ڼ�ȩת���ʺ��¶ȵĹ�ϵ��ͼ��
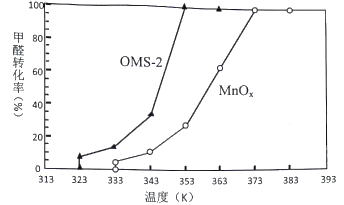
��ͼ��֪��OMS-2��MnOx��ȣ���Ч�ʽϸ���____________________��ԭ����________________��
��5����ȩ(HCHO)��OMS-2����������������CO2��H2O��������OMS-2��ij�ܱտռ�ļ�ȩ���д�����ʵ�飬ʵ�鿪ʼʱ���ÿռ��ڼ�ȩ����Ϊ1.22mg/L��CO2����Ϊ0.590mg/L��һ��ʱ�����CO2����������1.25mg/L����ʵ���м�ȩ��ת����Ϊ_______________________��
���𰸡� -1 Fe���� 5:1 2MnO4-+ 2S2O82-+10Mn2++11H2O=Mn12O19��+4SO42-+22H+ H2SO4 ���� OMS-2 OMS-2 ��MnOx������������ķ�Ӧ��Ũ�ȸ��ߣ���Ӧ���ʸ��� 36.9%
�����������������̰��������װ�(OMS-2)�ĺϳ�Ϊ���忼�鹤������ͼ�����ڿ���ѧ�����ۺϷ�����������1��FeS2����Ԫ�صĻ��ϼ�Ϊ+2�ۣ���Ԫ�صĻ��ϼ���-1�����̿�ͻ�����������������ҺA�к���Fe2+������H2O2��Fe2+����ΪFe3+������pH����Ԫ�س�ȥ�õ�MnSO4��H2O����2��Mn12O19����Ԫ�ػ��ϼ۾�Ϊ-2�ۣ���Mn (��)Ϊx������Mn (��)Ϊ12-x�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ0������3x+4(12-x)=2��19,xΪ10��Mn (��)Ϊ2��Mn (��)��Mn (��) ���ʵ���֮��Ϊ5:1�������������������е�ԭ��KMnO4��K2S2O8��MnSO4��H2O�����ʵ�����1:1:5��Ӧ����������Ԫ��ȫ����SO42-����ʽ���ڣ��÷�Ӧ�����ӷ���ʽΪ2MnO4-+ 2S2O82-+10Mn2++11H2O=Mn12O19��+4SO42-+22H+����3�����ݷ�Ӧ����ʽ��֪����ҺB�к��е�K2SO4��H2SO4���ù�����ѭ��ʹ�õ����ʻ�ѧʽ��H2SO4��K2SO4��ũҵ�����п������طʣ���4����ͼ����Կ�������ͬ�¶��£�OMS-2������ʱ��������OMS-2 ��MnOx������������ķ�Ӧ��Ũ�ȸ��ߣ���Ӧ���ʸ��죬��OMS-2��MnOx��ȣ���Ч�ʽϸ���OMS-2����5�������ΪVL��CO2������0.590mg/L������1.25mg/L��CO2��������0.66mg/L����Ӧ���ɵ�CO2�����ʵ���Ϊ![]() ������ԭ�Ӹ����غ㣬���뷴Ӧ�ļ�ȩ�����ʵ���Ϊ
������ԭ�Ӹ����غ㣬���뷴Ӧ�ļ�ȩ�����ʵ���Ϊ![]() ���ʸ�ʵ���м�ȩ��ת����Ϊ
���ʸ�ʵ���м�ȩ��ת����Ϊ =36.9%��
=36.9%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������:
��1���������������������ʴ��ÿ����ʴ����ʧ�ĸ���ռ���������������ķ�֮һ�� 
�ٸ�����ʴ��Ҫ��������ʴ���ø�ʴ�����е�������ӦʽΪ ��
��Ϊ�˽���ijˮ�����բ�ű���ʴ�����ʣ����Բ�����ͼ����ʾ�ķ��������к�������բ���ϵĹ������ R ���Բ��� ��
A��ͭB����C��пD��ʯī
����ͼ�ҷ���Ҳ���Խ�����բ�ŵĸ�ʴ���ʣ�������բ��Ӧ��������ֱ����Դ�����ϣ�
��2�����ݷ�Ӧ Fe+Fe2��SO4��3�T3FeSO4��Ƶ�˫Һԭ�����ͼ����ʾ��
�ٵ缫��IJ���Ϊ�����������ձ� A �еĵ������ҺΪ���ѧʽ��
�ڵ缫�����ĵ缫��ӦʽΪ ��
��3��ijͬѧ��װ����ͼ����ʾ�ĵ绯ѧװ�ã��缫��Ϊ Al�������缫��Ϊ Cu�� �ٵ缫��Ϊ�������������������������������������Ӧ����������� ԭ�������缫��ӦʽΪ���缫��Ϊ�������������������������������
��������ʢ�к� KNO3 ��Һ����֬�������е� K+����������ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1032molL��1 HCl��Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ��
��1��ijͬѧ�����в������ʵ�飺��ȡһ��ƿ���ô���NaOH��Һ��ϴ���Σ� ������ƿ�м��� 25��.00 mL����NaOH��Һ���ۼ��뼸��ʯ���Լ���ָʾ������ȡһ֧��ʽ�ζ��ܣ�ϴ�Ӹɾ��� ��ֱ������ʽ�ζ�����ע�������Һ�����еζ��� ������ע���ŵζ�����������ҺҺ���½���ֱ���ζ��յ㣮
�������������д�������Ϊ
��2��ȡ��25.00 mL����NaOH��ҺӦ��������ѡ����ס������ҡ���װ�ã���ȡ��NaOH��Һ��ʼƽ�Ӷ���������ʱ���Ӷ������ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰�� ![]()
��3�����ζ���ʼǰ�ζ��ܼ�������һ���ݣ��ζ�������������ʧ�� ��ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰��
��4����ƽ��ʵ�����Σ���¼���������±�
�ζ����� | ������Һ�������/mL�� | ��HCl��Һ����� | |
�ζ�ǰ������/mL�� | �ζ��������/mL�� | ||
�� | 25.00 | 1.02 | 21.04 |
�� | 25.00 | 2.00 | 22.98 |
�� | 25.00 | 0.20 | 20.18 |
�Լ������NaOH��Һ�����ʵ���Ũ�ȣ��г�������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ճ������ҵ�����г��õ�Ư������������û��Ư�����õ���
A��HClO B��SO2 C��������ˮ D��CaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͬ��N2��CO��������������һ����ͬ���ǣ� ��
A.���ʵ���
B.���Ӹ���
C.ԭ�Ӹ���
D.�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������� NaOH ��Һ��Ӧ����������ˮ�Ļ����� M�������� M ��Һ����ϡ�����У��а�ɫ���������������������
A.Fe2O3B.SiO2C.A12O3D.MgO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У�b�缫�ý���M�Ƴɣ�a��c��dΪʯī�缫����ͨ��Դ������M������b����ͬʱa��d�缫�ϲ������ݣ��Իش� 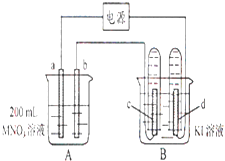
��1��aΪ����d���ĵ缫��ӦʽΪ�� ��
��2����ʼʱ����B�ձ�������μ��ε�����Һ�����ܹ۲쵽�������� �� ������һ��ʱ�������c���ϵ��Թ���Ҳ�ռ��������壬��ʱc���ϵĵ缫��ӦΪ�� ��
��3����d�缫���ռ���44.8ml���壨��״����ʱֹͣ��⣬��b�缫�ϳ�������M������Ϊ0.432g����˽�����Ħ������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ĵ��ʺͻ������У���Ԫ�صĻ��ϼ���ߵ��ǣ� ��
A.S
B.SO2
C.H2S
D.H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀ�������Ӳ��þ��ˮ��ʯ[Mg2Al(OH)6Cl��xH2O]��һ���������ӽ������ϣ����ڸ�������ȫ�ֽ�ΪMgO��Al2O3��HCl��ˮ������������ͼװ�ý���ʵ��ȷ���仯ѧʽ(�̶�װ����ȥ)��
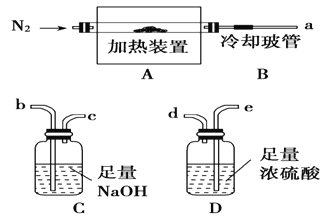
��1��Mg2Al(OH)6Cl��xH2O�ȷֽ�Ļ�ѧ����ʽ___________________________��
��2����ֻͨ���ⶨװ��C��D��������ȷ��x����װ�õ�����˳��Ϊ________(�����������ýӿ���ĸ��ʾ)������C��������________��װ�����Ӻ�����Ҫ���еIJ�����������________��
��3������ǰ��ͨN2�ž�װ���еĿ�������ȡC��D�ij�ʼ�������ٳ���ͨ��N2��������______________________��_________________�ȡ�
��4����ȫ�ֽ����C����3.65 g��D����9.90 g����x��________����ȡ����ȴ����B�����ʵ�飬�ⶨ��xֵ��________(����ƫ��������ƫ����)��
��5������ˮ��ʯ�ڿ����з���ʱ������Ӧ����[Mg2Al(OH)6Cl1��2y��(CO3)y��zH2O]�����������ܷ������Ƶ��ȷֽⷴӦ�����Դ�����Ϊ��Ʒ����(2)�����ӵ�װ�ú��Լ�����ʵ��ⶨz�����ⶨD�������⣬���ٻ���ⶨ___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com