
分析 1mol水的质量=1mol×18g/mol=18g=0.018g,水的密度为1×103kg/m3,根据V=$\frac{m}{ρ}$计算水的体积;1mol水中其分子个数为NA,先计算一个水分子体积,再计算在1cm的长度上排列水分子个数;根据体积公式计算水分子之间的距离.
解答 解:1mol水的质量=1mol×18g/mol=18g=0.018kg,水的密度为1×103kg/m3,水的体积V=$\frac{m}{ρ}$=$\frac{0.018kg}{1000kg/{m}^{3}}$=1.8×10-5m3;
1mol水分子个数为NA,则每个水分子体积=$\frac{1.8×1{0}^{-5}{m}^{3}}{6.02×1{0}^{23}}$=3×10-29m3,水分子间距等于水分子直径=$\root{3}{30}$×10-10m,则1cm长度上排列水分子个数=$\frac{0.01m}{\root{3}{30}×1{0}^{-10}m}$=$\frac{1}{\root{3}{30}}×1{0}^{8}$,
故答案为:1.8×10-5m3;$\frac{1}{\root{3}{30}}×1{0}^{8}$;$\root{3}{30}$×10-10.
点评 本题考查物质的量的有关计算,侧重考查学生分析计算能力,注意计算时要将水分子可作是球形分子,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | Mg 2++2HC03-+Ca 2++2OH -→MgC03↓+CaC03↓+2H20 | |
| B. | Mg 2++2HC03-+2Ca 2++4OH -→Mg(OH)2↓+2CaC03↓+2H20 | |
| C. | Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20 | |
| D. | Ca2++C032-→CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步均为氧化还原反应 | |
| C. | 可溶性铁盐和铝盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管内壁的银镜可用玻璃棒将其刮下或浸泡氨水的方法清洗去除 | |
| B. | 为降低铜锌原电池中的极化作用,可在电解质溶液中加入少量双氧水 | |
| C. | 为检验CO气体的纯度,用排空气法收集一试管气体,然后移近酒精灯火焰点燃.听有无尖锐爆鸣声 | |
| D. | 用pH计、浊度计(浊度即水的浞浊程度.浊度计是测定水浊度的装置)均不可用于探究硫代硫酸钠与硫酸反应速率的影响因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
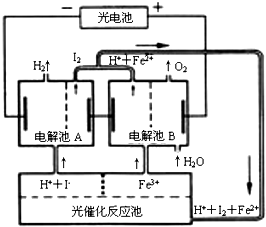
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
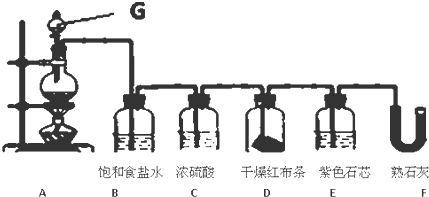
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷在一定条件下都可以与氯气反应 | |
| B. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| C. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯和乙烷都可以与氢气发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com