
| A. | 无机盐 | B. | 油脂 | C. | 水 | D. | 蛋白质 |
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡体系中氮气、氢气、氨的物质的量保持不变 | |
| B. | 平衡体系中氮气、氢气、氨的浓度保持不变 | |
| C. | 单位时间内生成的氨和分解的氨物质的量相同 | |
| D. | 单位时间内消耗的氮气和氢气与生成的氨气物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

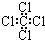
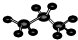
| A. | ①④ | B. | ①②④ | C. | ①②③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
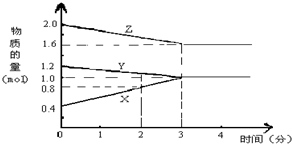
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2和CH2=CH-CH=CH2 | B. | C4H8和C6H12 | ||
| C. | 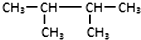 和(CH3)2CHCH(CH3)2 和(CH3)2CHCH(CH3)2 | D. | C2H6和C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
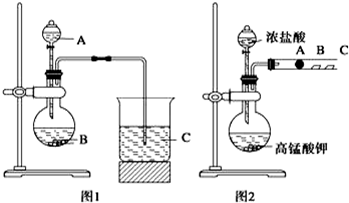
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低:HF>HCl | B. | 熔点由高到低:K>Li | ||
| C. | 硬度由大到小:金刚石>晶体硅 | D. | 晶格能由大到小:NaF>NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
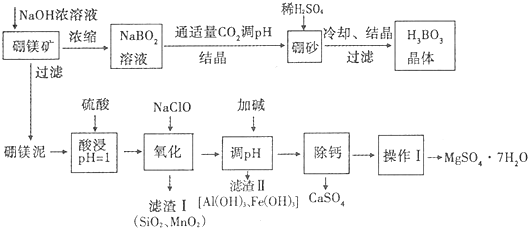
| 化合物 | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp近似值 | 10-11 | 10-16 | 10-38 | 10-33 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
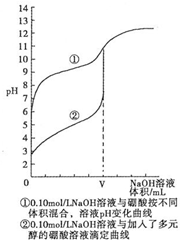
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com