
分析 (1)根据V=$\frac{N}{{N}_{A}}{V}_{m}$进行计算;n(H)=3n(NH3),计算氢原子的物质的量,根据c=$\frac{n}{V}$求氨水的物质的量;
(2)根据n=m$\frac{m}{M}$计算7.1g Na2SO4的物质的量,再根据c=$\frac{n}{V}$计算Na2SO4溶液的物质的量浓度,从而求出钠离子的物质的量;根据钠守恒求氯化钠的物质的量,然后求其质量;
(3)Zn的活泼性大于Fe、Cu,所以Zn能置换出Fe、Cu,该混合溶液中根据化学式得n(Fe2+)+n(Cu2+)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×amol/L×0.4L=0.2amol,Zn的摩尔质量大于Fe、Cu,所以Zn置换出Fe、Cu时导致固体质量减少(b-c)g,列方程组计算C(Fe2+)、C(Cu2+).
解答 解:(1)标准状况下,1.806×1022个NH3分子的体积为$\frac{1.806×1{0}^{22}}{6.02×1{0}^{23}}×22.4$=0.672L,所以氢原子的物质的量为0.03×3=0.09mol,溶于水形成200ml溶液所得氨水的物质的量浓度为$\frac{0.03mol}{0.2L}$=0.15mol/L,
故答案为:0.672L;0.09mol;0.15mol/L;
(2)7.1g Na2SO4的物质的量为$\frac{7.1}{142}$=0.05mol,故Na2SO4溶液的物质的量浓度为$\frac{0.05mol}{0.2L}$=0.25mol/L,溶液中c(Na+)=2c(Na2SO4)=0.25mol/L×2=0.5mol/L;n(NaCl)=0.6×0.2-0.05×2=0.02mol,所以氯化钠的质量为:0.02mol×58.5g/mol=1.17g,
故答案为:0.5mol/L;1.17g;
(3)Zn的活泼性大于Fe、Cu,所以Zn能置换出Fe、Cu,该混合溶液中根据化学式得n(Fe2+)+n(Cu2+)=$\frac{1}{2}$n(Cl-)=amol/L×0.4L=0.2amol,Zn的摩尔质量大于Fe、Cu,所以Zn置换出Fe、Cu时导致固体质量减少(b-c)g,设FeCl2和CuCl2分别为xmol、ymol,则:
Zn+Cu2+=Cu+Zn2+质量减少
1mol 1g
ymol yg
Zn+Fe2+=Fe+Zn2+质量减少
1mol 9g
xmol 9xg
可得方程组:
解得$\left\{\begin{array}{l}{x+y=0.2a\\;}\\{9x+y=b-c}\end{array}\right.$解之得:$\left\{\begin{array}{l}{x=\frac{1}{8}(b-c-0.2a)}\\{y=\frac{1}{8}(1.8a-b+c)}\end{array}\right.$
故C(Fe2+)=$\frac{\frac{1}{8}(b-c-0.2a)mol}{0.4L}$=$\frac{1}{16}$(5b-5c-a)mol/L
C(Cu2+)=$\frac{\frac{1}{8}(1.8a-b+c)mol}{0.4L}$=$\frac{1}{16}$(9a-5b+5c)mol/L
故答案为:$\frac{1}{16}$(5b-5c-a);$\frac{1}{16}$(9a-5b+5c).
点评 本题考查常用化学计量的有关计算,比较基础,注意对公式的理解与灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 将浓硫酸转移至容量瓶中,加水稀释至距标线2~3 cm处,改用胶头滴管定容 | |
| B. | 用酒精萃取碘水中的碘单质 | |
| C. | 进行液体蒸馏实验时,冷凝管中应充满自来水 | |
| D. | 某溶液加入盐酸酸化的氯化钡溶液后,出现白色沉淀,则原溶液中必有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 运用蒸馏的方法,可以分离沸点相差较大的固体混合物 | |
| B. | 铁的化合物应用十分广泛,如FeCl3、FeSO4是优良的净水剂 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 工业上以氯气和石灰乳为原料制造漂白粉,漂白粉主要成分为Ca(ClO)2和CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | z=4 | B. | B的转化率是40% | ||
| C. | A的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来的1.2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | HNO3的摩尔质量是63g | |
| C. | 我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 | |
| D. | 1mol氧含6.02×1023个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) | B. | c(H+)+c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(OH-)═c(H+)+c(CH3COO-) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A. | a点:由水电离出的c(H+)>1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)<c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
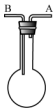 利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr
利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通过Na2O2使其增重2.8g,反应中转移电子数为0.2NA | |
| B. | 3.36 L NO2与水充分反应转移的电子数目为0.1NA | |
| C. | 常温常压下,5.6g环丙烷和聚乙炔的混合物中含有的碳原子数为0.4NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com