
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1分析 (1)a.同一周期,随着原子序数的增大,原子半径逐渐减小,简单离子半径先减小后增大再减小;
b.同一周期元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
d.同一周期元素,其单质的熔点先增大后减小;
(2)第三周期中,次外层电子数为8,原子最外层电子书与次外层电子数相同,则该元素为氩;第三周期中简单阳离子为钠离子、镁离子和铝离子,金属的还原性越强,对应离子的氧化性越弱;
(3)氧化镁熔点远远大于氯化镁,电解MgO冶炼Mg浪费能源;氯化铝是共价化合物,熔融状态下不导电;
(4)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,每生成1.12kg纯硅需吸收akJ热量,结合物质的量与反应放出的热量成正比计算;
(5)浓硫酸具有强氧化性、酸性,P2O5是非氧化性干燥剂;
(6)根据题干信息判断该无氧酸盐为氯化钾,再根据化合价变化判断另一种无氧酸盐名称,最后根据化合价升降相等配平即可;
(7)电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出.
解答 解:(1)a.第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,从阳离子到阴离子,半径在增大,故a错误;
b.同一周期中,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,故b正确;
c.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故c错误;
d.同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故d错误;
故答案为:b;
(2)原子最外层电子书与次外层电子数相同,而第三周期中次外层电子为8,该元素原子结构示意图为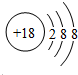 ,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
,则该元素为氩;金属的还原性越强,对应离子的氧化性越弱,所以第三周期中氧化性最弱的为Na+,
故答案为:氩;Na+;
(3)氧化镁熔点远远大于氯化镁,电解MgO冶炼Mg浪费能源,所以用熔融态氯化镁冶炼镁;
氯化铝是共价化合物,熔融状态下以分子存在,所以不导电,则用熔融氧化铝冶炼Al,
故答案为:MgO的熔点高,熔融时消耗更多能量,增加生产成本;氯化铝是共价化合物,熔融态氯化铝难导电;
(4)四氯化硅为共价化合物,氯原子和硅原子都达到8个电子,四氯化硅的电子式为 ,每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{\frac{a}{1.12×1{0}^{3}}}{28}$=0.025aKJ,所以热化学方程式为:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1,故答案为:
,每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为$\frac{\frac{a}{1.12×1{0}^{3}}}{28}$=0.025aKJ,所以热化学方程式为:SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1,故答案为: ;SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1;
;SiCl4(g)+2H2(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025a kJ•mol-1;
(5)浓硫酸具有强氧化性、酸性,不能干燥具有还原性、碱性的气体,
a.NH3为碱性气体,不能用浓硫酸和五氧化二磷干燥,可用碱石灰干燥,故错误;
b.HI为还原性气体,不能利用浓硫酸干燥,可以利用P2O5干燥,故正确;
c.SO2为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故错误;
D、CO2为酸性气体,可以用浓硫酸、五氧化二磷或无水氯化钙干燥,故D错误;
故答案为:b;
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸为KCl,KCl中氯元素化合价为-1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4,故答案为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4;
(7)电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以化学方程式为:NaCl+3H2O═NaClO3+3H2↑
;两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;故答案为:NaCl+3H2O═NaClO3+3H2↑
;相同温度下,溶解度小的物质先析出.
点评 本题考查较综合,涉及同一周期中元素周期律与原子结构的关系、化学方程式的书写等知识,注重高频考点的考查,题目难度较大,有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:推断题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
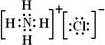 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50% | B. | 48.8% | C. | 42.1% | D. | 72.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一般来说,酸、碱、盐是电解质,非金属氧化物是非电解质 | |
| B. | 常见弱电解质有弱酸、弱碱、水等 | |
| C. | 强电解质的水溶液导电能力一定强,弱电解质的水溶液导电能力一定弱 | |
| D. | 蔗糖、酒精都属于非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
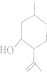 )是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).
)是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).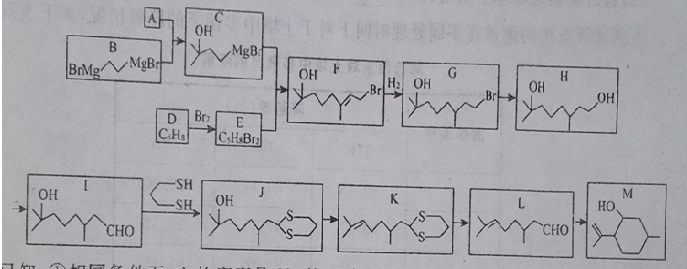
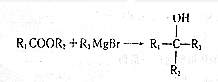
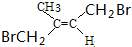 .
.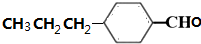 (写出其中任意一种的结构简式).
(写出其中任意一种的结构简式). 的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$
的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$ (无机试剂任选).
(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com