
| A. | CH3CH(CH3)CH(C2H5)CH3的系统命名法的名称为2-甲基-3-乙基丁烷 | |
| B. | 乙炔的结构简式为CHCH,乙烯的球棍模型为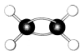 | |
| C. | 己烯和苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| D. | 向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀 |
分析 A.判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
烷烃命名原则:
①长-----选最长碳链为主链;
②多-----遇等长碳链时,支链最多为主链;
③近-----离支链最近一端编号;
④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
B.含官能团的有机物需要结构简式中写出;
C.苯分子中碳碳键是特殊的化学键,不能和高锰酸钾溶液褪色;
D.溴乙烷中的溴为溴原子,不是溴离子.
解答 解:A.CH3CH(C2H5)CH(CH3)2的最长碳链含5个碳原子,离取代基近的一端给主碳链编号得到名称为:2,3-二甲基戊烷,故A错误;
B.乙炔的结构简式为CH≡CH,乙烯的球棍模型为 ,故B错误;
,故B错误;
C.己烯和苯都是不饱和烃,己烯能使酸性高锰酸钾溶液褪色,苯分子中六个碳碳键完全等同,不能使酸性高锰酸钾溶液褪色,故C错误;
D.溴乙烷中的溴为溴原子,不是溴离子,向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀,故D正确;
故选D.
点评 本题考查了有机物的命名、物质结构和性质等知识点,掌握基础是解题关键,题目难度中等.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A、C两点对应溶液均呈中性 | |
| C. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-) | |
| D. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E、N、M、P | B. | M、N、P、E | C. | P、M、N、E | D. | P、N、M、E |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点(K) | >3823 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 2823 |
| 硬度(Moh) | 10 | 7.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BeCl2 CO2 | B. | H2O SO2 | C. | BF3 NCl3 | D. | SiCl4 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
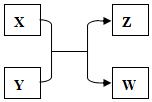 X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).
X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H═2×(-57.3)kJ•mol-1 | |
| C. | Mg在CO2中燃烧生成MgO和C,该反应中化学能全部转化为热能 | |
| D. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com