
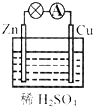
| A. | 负极发生的反应是Zn-2e-═Zn2+ | B. | 正极发生的是氧化反应 | ||
| C. | 一段时间后,溶液的pH减小 | D. | 一段时间后,铜片的质量增加 |
分析 A、原电池中锌做负极失电子生成锌离子;
B、装置图为原电池,锌做负极失电子发生氧化反应,铜做正极得到电子发生还原反应;
C、溶液中氢离子在铜电极上得到电子生成氢气,溶液中氢离子浓度减小;
D、溶液中氢离子在铜电极上得到电子生成氢气,所以铜片的质量不变.
解答 解:A、原电池中锌做负极失电子生成锌离子,负极电极反应为:Zn-2e-=Zn2+,故A正确;
B、分析装置图可知,锌做负极失电子发生氧化反应,铜做正极得到电子发生还原反应,故B错误;
C、溶液中氢离子在铜电极上得到电子生成氢气,2H++2e-=H2↑,溶液中氢离子浓度减小,溶液PH增大,故C错误;
D、溶液中氢离子在铜电极上得到电子生成氢气,2H++2e-=H2↑,所以铜片的质量不变,故D错误;
故选A.
点评 本题考查了原电池原理的分析判断,电极名称、电极反应和溶液PH变化等,原电池原理是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 只存在于乙酸分子中 | B. | 只存在于乙醇分子中 | ||
| C. | 只存在于乙醇、乙酸乙酯分子中 | D. | 只存在于乙酸、乙酸乙酯分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{4b-2c}{3a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与水以任意比互溶 | B. | 无色、无味的液体 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 能与金属钠发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,它的物质的量浓度仍为0.35 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com