
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
分析 A.能和酸反应生成盐和水的氧化物属于碱性氧化物;
B.氧化钠和水蒸气反应生成氢氧化钠;
C.在呼吸面具中,Na2O2与CO2发生化合生成Na2CO3和氧气常作供氧剂,而Na2O与CO2发生化合只生成Na2CO3;
D.过氧化钠在水溶液中剧烈反应生成氧气.
解答 解:A.能和酸反应生成盐和水的氧化物属于碱性氧化物,过氧化钠和酸反应生成盐和水以及氧气,不属于碱性氧化物,故A错误;
B.氧化钠和水蒸气反应生成氢氧化钠变质,需要密封保存,故B错误;
C.在呼吸面具中,Na2O2与CO2发生化合生成Na2CO3和氧气常作供氧剂,而Na2O与CO2发生化合只生成Na2CO3,故C正确;
D.将Na2O2放入氢氧化钠溶液中,过氧化钠和水发生反应,生成氧气,故D错误;
故选C.
点评 本题考查钠的重要化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握氧化钠、过氧化钠性质的特点,学习中注意相关基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br- | |
| B. | 水电离出的c(H+)=10-13mol•L-1的溶液中:Fe3+、K+、CO32-、SO32- | |
| C. | 室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中:Al3+、Na+、SiO32-、HCO3- | |
| D. | 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃、l0IKPa下,NA个C18O2分子的质量为48g | |
| B. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| C. | 1mol白磷(P4)分子中所含化学键的数目为4NA | |
| D. | 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
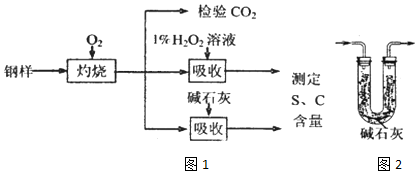
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
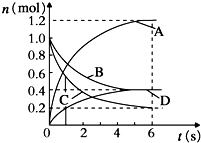
| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液中,溶液的红色褪去 | |
| B. | 将5滴氯化铁饱和溶液滴入25mL煮沸的蒸馏水中继续加热,液体变红褐色 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 将葡萄糖溶液加入新制Cu(OH)2悬浊液加热至沸腾,出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
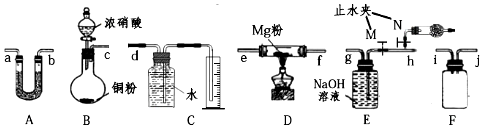
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com