分析:(1)化学平衡常数,是指在一定温度下,可逆反应都达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)由表中数据可知,平衡时c(NO)=
=0.0035mol/L,由方程式2NO(g)+O
2(g)?2NO
2(g)可知,平衡时△c(NO):△c(O
2):△c(NO
2)=2:1:2,据此判断表示NO
2的浓度变化的曲线;由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,根据v=
计算v(NO),再根据速率之比等于化学计量数之比计算v(O
2);
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)25℃时,生成1mol NO
2,热量变化为56.4kJ,则生成2mol NO
2,热量变化为112.8kJ,据此写出热化学方程式;
(5)根据化学反应速率的影响因素和化学平衡移动影响因素判断;
(6)根据反应物和生成物写出化学方程式;判断出氧化产物和还原产物,计算得到答案.
解答:
解(1)可逆反应2NO(g)+O
2(g)?2NO
2(g)的平衡常数k=
,故答案为:
;
(2)由方程式2NO(g)+O
2(g)?2NO
2(g)可知,平衡时△c(NO):△c(O
2):△c(NO
2)=2:1:2,由表中数据可知,平衡时△c(NO)=
=0.00625mol/L,曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO
2的浓度变化,
由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)=
=0.003mol/(L?s),根据速率之比等于化学计量数之比,故v(O
2)=
v(NO)=
×0.003mol/(L?s)=0.0015mol/(L?s),故答案为:b;0.0015mol/(L?s);
(3)A.未指明正逆速率,若都为同一方向速率,始终都存在v(NO
2)=2v(O
2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故A错误;
B.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故B正确;
C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v
逆(NO)=2v
正(O
2),说明到达平衡,故C正确;
D.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故D错误;
故选BC;
(4)25℃时,生成1mol NO
2,热量变化为56.4kJ,则生成2mol NO
2,热量变化为112.8kJ,据此写出热化学方程式为:2NO(g)+O
2(g)?2NO
2(g)△H=-112.8KJ/mol,故答案为:2NO(g)+O
2(g)?2NO
2(g)△H=-112.8KJ/mol;
(5)A.及时分离除NO
2气体,浓度降低,化学反应速率减小,故A错误;
B.正反应为放热反应,升高温度,化学平衡向逆反应方向移动,故B错误;
C.增大O
2的浓度,增大反应速率,且化学平衡向正反应方向移动,故C正确;
D.选择高效催化剂,只增大化学反应速率,不影响化学平衡移动,故D错误;
故选C;
(6)反应物为NH
3和NO,发生氧化还原反应,可得到产物为:N
2和H
2O,化学方程式为:4NH
3+6NO
5N
2+6H
2O;氧化产物和还原产物均为N
2,氧化产物与还原产物之差为0.15mol,即NH
3和NO物质的量之差为:0.15mol,且NH
3和NO物质的量之比为4:6,可知NH
3和NO物质的量分别为:0.3mol和0.45mol,则生成N
2物质的量为:0.3mol×
=0.75mol,标况下体积为:0.75mol×22.4L/mol=16.8L,故答案为:4NH
3+6NO
5N
2+6H
2O;16.8L.

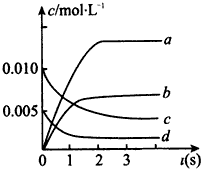 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示





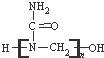 的合成单体之一是CH3OH
的合成单体之一是CH3OH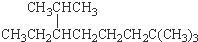 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷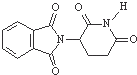 的分子式为C13H8O4N2
的分子式为C13H8O4N2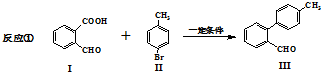
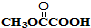 与
与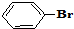 也可以发生类似反应①的反应,有机产物的结构简式为
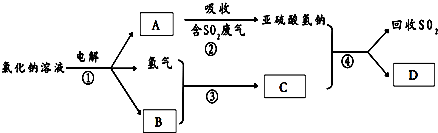
也可以发生类似反应①的反应,有机产物的结构简式为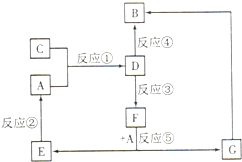 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知: