
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是( )
A.2∶3 B.3∶2 C.4∶3 D.1∶3
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平_________________________。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO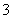 反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式___________________。
反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式___________________。
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O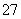 ,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式___________。
,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式___________。
(3)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为____________________________,
反应消耗1 mol NaBH4时转移的电子数目为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是4Ag+2H2S+O2===2X+2H2O,下列说法正确的是( )
A.X的化学式为AgS
B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂
D.每生成1 mol X,反应转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
化学镀镍的溶液中含有Ni2+和H2PO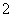 ,在酸性条件下发生以下镀镍反应:
,在酸性条件下发生以下镀镍反应:
Ni2++____H2PO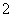 +__________—→____Ni+____H2PO
+__________—→____Ni+____H2PO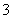 +__________
+__________
①请配平上述化学方程式。
②上述反应中,若生成1 mol H2PO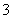 ,反应中转移电子的物质的量为________。
,反应中转移电子的物质的量为________。
(2)①高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
若生成2 mol Na2FeO4,则反应中电子转移的物质的量为________mol。
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1 mg的水体样本,需要1.2 mg·L-1高铁酸钾________ L。
(3)S2O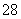 具有强氧化性,其还原产物为SO
具有强氧化性,其还原产物为SO ,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:________________________________________________________________________。
,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:________________________________________________________________________。
(4)①在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
FeSO4+____KNO3+____H2SO4—→____K2SO4+____Fe2(SO4)3+____NO↑+____H2O;其中氧化剂为__________。
②铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH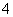 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO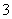
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质的说法中正确的是( )
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离一般都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com